题目内容
15.下列除去杂质(括号内为杂质)的方法正确的是( )①乙烷(乙烯):光照条件下通入Cl2,气液分离
②乙炔(硫化氢):酸性高锰酸钾溶液,洗气
③苯(苯酚):用浓溴水洗涤,分液
④乙醇(乙酸):加足量生石灰,蒸馏.
| A. | 都不正确 | B. | ②③ | C. | ④ | D. | ③④ |
分析 ①光照下乙烷发生取代反应;
②二者均能被高锰酸钾氧化;
③溴、三溴苯酚均可溶于苯;
④乙酸与CaO反应后,增大与乙醇的沸点差异.
解答 解:①光照下乙烷发生取代反应,将原物质反应掉,不能除杂,应选溴水、洗气除杂,故错误;
②二者均能被高锰酸钾氧化,不能除杂,应选硫酸铜溶液除杂,故错误;
③溴、三溴苯酚均可溶于苯,引入新杂质,不能除杂,应选NaOH溶液、分液除杂,故错误;
④乙酸与CaO反应后,增大与乙醇的沸点差异,然后蒸馏可除杂,故正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应及混合物分离方法等为解答的关键,注意有机物的性质,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
5.甲烷燃料电池以铂丝为电极,KOH为电解质溶液,从两极分别通入甲烷和氧气即可产生电流.关于此燃料电池的下列叙述正确的是( )
| A. | 通入CH4的电极为正极 | |
| B. | 正极的电极反应式为:202+8e-+4H20=80H- | |
| C. | 若甲烷通人量为1.12L(标准状况)且反应完全,则电池中有0.1mol02被氧化 | |
| D. | 通入甲烷的电极的电极反应式为:CH4+202+4e-=C02+2H20 |
3.使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O,如图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果.下列说法不正确的是( )
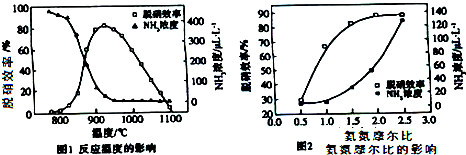

| A. | 从图1判断,该反应的正反应方向是放热反应 | |
| B. | 从图2判断,减少氨气的浓度有助于提高NO的转化率 | |
| C. | 从图1判断,脱硝的最佳温度约为925℃ | |
| D. | 从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5 |
10.W、X、Y、Z为原子序数递增的四种短周期元素.W是原子半径最小的元素,X的一种核素在考古时常用来鉴定一些文物的年代,Y是植物生长所需化学肥料中主要的营养元素之一,Z原子的最外层电子数是X原子最外层电子数的1.5倍.下列说法正确的是( )
| A. | 氢化物的沸点:Z一定高于Y | |
| B. | 最高价氧化物对应水化物的酸性:X强于Y | |
| C. | W、X、Y、Z都能分别与氯元素形成共价化合物 | |
| D. | 仅由W、Y、Z三种元素组成的化合物不可能属于盐类 |
7.2007年诺贝尔化学奖得主--德国科学家格哈德•埃特尔通过对有关一氧化碳在金属铂表面的氧化过程的研究,发明了汽车尾气净化装置.净化装置中的催化转化器,可将CO、NO、NO2和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害.下列有关说法不正确的是( )
| A. | 催化转化器中的铂催化剂可加快CO的氧化 | |
| B. | 铂表面做成蜂窝状更有利于提高催化效果 | |
| C. | 在铂催化下,NO、NO2可被CO还原成N2 | |
| D. | 碳氢化合物在铂催化下,被CO直接氧化成CO2和H2O |
5.(1)氨催化氧化法是工业制硝酸的主要方法,可进行连续生产.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
①写出合成氨反应N2(g)+3H2(g)?2NH3(g)的平衡常数表达式:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{3})}$
②上表中K1>K2(填“>”、“=”或“<”).
(3)如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图.
①下列说法正确的是ABD(填序号).
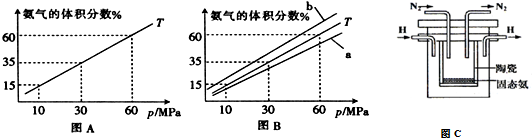
A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2)=3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为32.61%.
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式N2+6e-+6H+=2NH3.
(5)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是BD.
A.25℃时,饱和Mg(OH)2溶液中c(OH-)大于饱和MgF2溶液中c(F-)
B.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561 mol•L-1,则溶液的pH=9
C. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2.
已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
②上表中K1>K2(填“>”、“=”或“<”).
(3)如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图.
①下列说法正确的是ABD(填序号).

A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2)=3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为32.61%.
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式N2+6e-+6H+=2NH3.
(5)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是BD.
A.25℃时,饱和Mg(OH)2溶液中c(OH-)大于饱和MgF2溶液中c(F-)
B.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561 mol•L-1,则溶液的pH=9
C. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2.
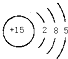 ;
;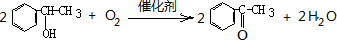 .
. .
.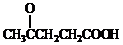 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):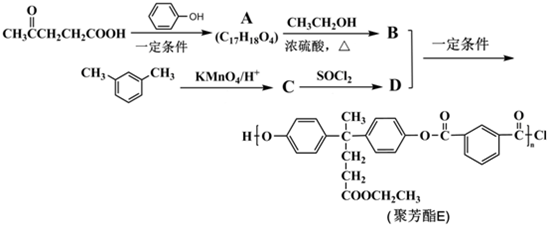
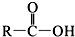 +SOCl2→
+SOCl2→ +SO2+HCl
+SO2+HCl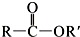 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)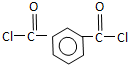 .
.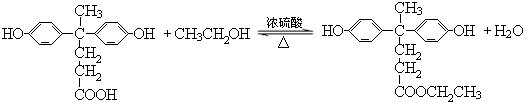 ,.
,.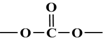 结构写出F与足量NaOH溶液共热反应的化学方程式:
结构写出F与足量NaOH溶液共热反应的化学方程式: .
.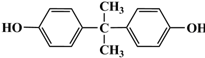 的路线.
的路线.