题目内容
14.几种短周期元素的原子半径及主要化合价如表:| 元素代号 | X | Y | Z | W | V |
| 原子半径/nm | 0.090 | 0.118 | 0.075 | 0.073 | 0.102 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 | +6、-2 |
| A. | X、Z、W位于同周期,Y与V位于同周期 | |
| B. | Y3+与V2-的核外电子数相等 | |
| C. | Y与W形成的化合物具有两性 | |
| D. | Z的氢化物可与V的最高价氧化物的水溶液反应生成盐 |
分析 短周期元素中,W、V都有-2价,处于ⅥA族元素,V有+6价,W无正价,且V的原子半径较大,则V为S元素、W为O元素;Z元素有+5、-3价,处于VA族,原子半径小于S,故Z为N元素;X化合价为+2价,处于ⅡA族,原子半径小于S,与N、O相差不大,应处于第二周期,故X为Be;Y化合价为+3价,处于ⅢA族,原子半径大于S,故Y为Al,据此解答.
解答 解:短周期元素中,W、V都有-2价,处于ⅥA族元素,V有+6价,W无正价,且V的原子半径较大,则V为S元素、W为O元素;Z元素有+5、-3价,处于VA族,原子半径小于S,故Z为N元素;X化合价为+2价,处于ⅡA族,原子半径小于S,与N、O相差不大,应处于第二周期,故X为Be;Y化合价为+3价,处于ⅢA族,原子半径大于S,故Y为Al.
A.X、Z、W位于第二周期,Y与V位于第三周期,故A正确;
B.Y3+离子核外电子数为10,V2-的核外电子数为18,核外电子数不相等,故B错误;
C.Y与W形成的化合物为氧化铝,属于两性氧化物,故C正确;
D.Z的氢化物为NH3,V的最高价氧化物的水溶液为硫酸,二者反应可以生成硫酸铵,故D正确,
故选B.
点评 本题考查结构性质位置关系应用,难度不大,根据化合价及原子半径推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
5.甲烷燃料电池以铂丝为电极,KOH为电解质溶液,从两极分别通入甲烷和氧气即可产生电流.关于此燃料电池的下列叙述正确的是( )
| A. | 通入CH4的电极为正极 | |
| B. | 正极的电极反应式为:202+8e-+4H20=80H- | |
| C. | 若甲烷通人量为1.12L(标准状况)且反应完全,则电池中有0.1mol02被氧化 | |
| D. | 通入甲烷的电极的电极反应式为:CH4+202+4e-=C02+2H20 |
2.以乙醇为主要原料制乙二醛时,经过的反应为( )
| A. | 取代-消去-加成-氧化 | B. | 消去-加成-取代-氧化 | ||
| C. | 消去-取代-加成-氧化 | D. | 取代-加成-氧化-消去 |
9.关于化学键的叙述中,正确的是( )
| A. | HCl电离产生H+和Cl-,可判断HCl分子中存在离子键 | |
| B. | 阴、阳离子间通过静电引力所形成的化学键是离子键 | |
| C. | 化学变化过程,一定会破坏旧的化学键,同时形成新的化学键 | |
| D. | 不同元素组成的多原子分子中的化学键一定全是极性键 |
19.阿佛加德罗常数用NA表示,下列叙述正确的是( )
| A. | 室温时,1L pH=2的NH4Cl溶液中水电离出10-12 molH+ | |
| B. | 常温常压下,46g NO2含有的原子数等于3NA | |
| C. | 12g石墨含有4NA个自由移动的电子 | |
| D. | 22.4LCl2与足量NaOH反应,转移电子数NA |
3.使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)+O2(g)?4N2(g)+6H2O,如图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果.下列说法不正确的是( )
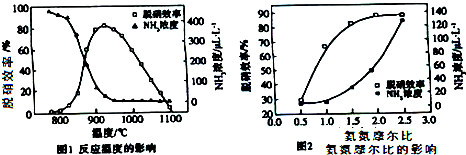

| A. | 从图1判断,该反应的正反应方向是放热反应 | |
| B. | 从图2判断,减少氨气的浓度有助于提高NO的转化率 | |
| C. | 从图1判断,脱硝的最佳温度约为925℃ | |
| D. | 从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5 |
 由Cu、Zn、稀H2S04形成如下图甲、乙装置.试回答以下问題:
由Cu、Zn、稀H2S04形成如下图甲、乙装置.试回答以下问題: ;
;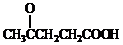 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):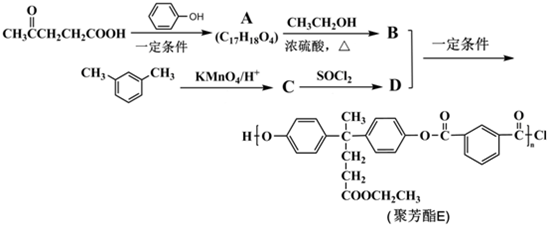
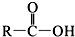 +SOCl2→
+SOCl2→ +SO2+HCl
+SO2+HCl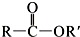 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)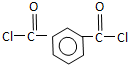 .
.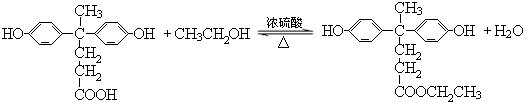 ,.
,.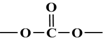 结构写出F与足量NaOH溶液共热反应的化学方程式:
结构写出F与足量NaOH溶液共热反应的化学方程式: .
.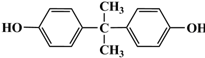 的路线.
的路线.