题目内容
11.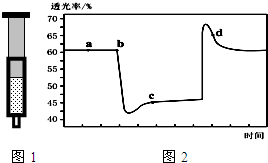 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是拉伸注射器 | |
| B. | d 点:v(正)<v(逆) | |
| C. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
分析 该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,c点后的拐点是拉伸注射器的过程,气体颜色变浅,透光率增大,据此分析.
解答 解:A、气体颜色变深,透光率变小,b点开始是压缩注射器的过程,故A错误;
B、c点后的拐点是拉伸注射器的过程,d点是平衡向气体体积增大的逆向移动过程,所以v(逆)>v(正),故B正确;
C、c点是压缩注射器后的情况,二氧化氮和四氧化二氮的浓度都增大,故C错误;
D、b点开始是压缩注射器的过程,平衡正向移动,反应放热,导致T(b)<T(c),故D错误;
故选B.
点评 本题通过图象和透光率考查了压强对平衡移动的影响,注意勒夏特列原理的应用,题目难度不大.

练习册系列答案
相关题目
1.甲、乙、丙三种含不相同离子的可溶性强电解质,它们所含的离子如下表所示:
若取等质量的甲、乙、丙配成相同体积的溶液,发现溶质的物质的量浓度c(甲)>c(乙)>c(丙),
则乙物质( )
| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH-、NO3-、SO42- |
则乙物质( )
| A. | 可能是Na2S04 | B. | 可能是NH4NO3 | C. | 可能是NaOH | D. | 一定不是(NH4)2SO4 |
2.下列对相应实验现象的描述不正确的是( )
| A. | 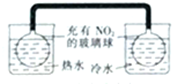 左边玻璃球内气体颜色更浅 | B. | 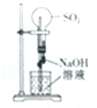 挤压胶头滴管产生喷泉现象 | ||
| C. | 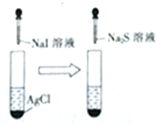 白色沉淀先变黄色再变黑色 | D. | 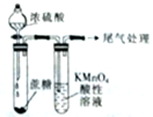 酸性高锰酸钾溶液褪色或变浅 |
3.基态原子的第一电离能处于B、N之间的元素有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
20.仅使用酸性高锰酸钾溶液,无法鉴别的物质组是( )
| A. | Na2S和AlCl3 | B. | 乙烷与乙烯 | C. | 直馏汽油与苯 | D. | CO2与SO2 |
1. 下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
(1)在元素 ①~⑧中,非金属性最强的元素是F(填元素符合).
(2)在元素 ①~⑧中,原子半径最大的是钠(填元素名称).
(3)元素⑤⑥⑦的最高价氧化物对应水化物,按碱性从强到弱的排列顺序是NaOH>Mg(OH)2>Al(OH)3(用化学式表示).
(4)用电子式表示元素①和⑧组成的化合物的形成过程 .
.
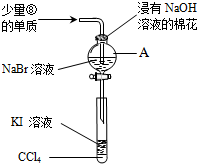
(5)为验证VIIA族部分元素非金属性的递变规律,设计了如图装置进行实验,请回答:
①仪器A的名称是分液漏斗,A中发生的反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)Cl2+2OH-=Cl-+ClO-+H2O.
③为验证溴与碘非金属性强弱:通入少量⑧的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到溶液分层,上层几乎无色,下层呈紫红色.
④VIIA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,电子层数增多,原子半径逐渐增大,得电子能力逐渐减弱.
 下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)在元素 ①~⑧中,原子半径最大的是钠(填元素名称).
(3)元素⑤⑥⑦的最高价氧化物对应水化物,按碱性从强到弱的排列顺序是NaOH>Mg(OH)2>Al(OH)3(用化学式表示).
(4)用电子式表示元素①和⑧组成的化合物的形成过程
 .
.(5)为验证VIIA族部分元素非金属性的递变规律,设计了如图装置进行实验,请回答:
①仪器A的名称是分液漏斗,A中发生的反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)Cl2+2OH-=Cl-+ClO-+H2O.
③为验证溴与碘非金属性强弱:通入少量⑧的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到溶液分层,上层几乎无色,下层呈紫红色.
④VIIA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,电子层数增多,原子半径逐渐增大,得电子能力逐渐减弱.
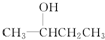 D.
D.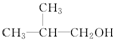 E.
E.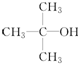

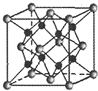 (1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.
(1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.