题目内容
16. (1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.
(1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子.①Y2X2分子中Y原子轨道的杂化类类型为sp1mol,Y2X2含有σ键的数目为3NA.
②化合物ZX3的沸点比化合物YX4的高,其主要原因是NH3分子间存在氢键.
③元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物 的分子式是N2O.
(2)过渡金属元素铁能形成多种配合物,如:K2[Fe(SCN)6]、Fe(CO)x等.
①基态Fe3+的M层电子排布式为3s23p63d5.
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=5.Fe(CO)x晶体属于分子晶体(填晶体类型).
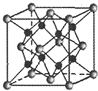
(3)Na和O形成的一种只含有离子键的离子化合物的晶胞结构如图所示:
①距离一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体.
②已知该晶胞的密度为ρg•cm-3,阿伏伽德罗常数为N,求晶胞的边长a=$\root{3}{{\frac{248}{{ρ•{N_A}}}}}$cm(用含p、NA的计算式表示).
分析 (1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,则X是H元素;
Y原子基态时最外层电子数是其内层电子数的2倍,为C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z为N元素;
①C2H2分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论判断C原子轨道的杂化类类型为;一个乙炔分子中1mol含有3个σ键;
②氢键导致物质的熔沸点升高;
③原子个数相等、价电子个数相等的微粒互为等电子体;
(2)①基态Fe3+的M层有13个电子,3s能级有一个电子、3p能级有6个电子、3d能级有5个电子,据此书写电子排布式;
②配合物Fe(CO)x中铁原子价电子数是8、CO中价电子数是10,配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则8+2x=18,x=5;配合物属于分子晶体;
(3)①根据图知,距离一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体;
②该晶胞中黑色小球个数是8、灰色小球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,二者个数变为为8:4=2:1,该化合物中一种元素化合价为+1价、一种为-2价,O为-2价、Na为+1价,所以化学式为Na2O,晶胞体积=$\frac{\frac{M}{{N}_{A}}×4}{ρ}$,晶胞边长=$\root{3}{V}$.
解答 解:(1)X、Y、Z三种短周期元素,其中X的一种核素是最简单的原子,则X是H元素;
Y原子基态时最外层电子数是其内层电子数的2倍,为C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z为N元素;
①C2H2分子中C原子价层电子对个数是2且不含孤电子对,根据价层电子对互斥理论知C原子轨道的杂化类类型为sp杂化;一个乙炔分子中1mol含有3个σ键,所以1mol C2H2含有σ键的数目为3NA,
故答案为:sp;3NA;
②氢键导致物质的熔沸点升高,氨气中存在氢键、四氯化碳中不含氢键,所以氨气熔沸点高于甲烷,故答案为:NH3分子间存在氢键;
③CO2与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是N2O,故答案为:N2O;
(2)①基态Fe3+的M层有13个电子,3s能级有一个电子、3p能级有6个电子、3d能级有5个电子,所以铁离子M层电子排布式3s23p63d5,故答案为:3s23p63d5;
②配合物Fe(CO)x中铁原子价电子数是8、CO中价电子数是10,配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则8+2x=18,x=5;配合物属于分子晶体,该物质为分子晶体,
故答案为:5;分子晶体;
(3)①根据图知,距离一个阴离子周围最近的所有阳离子为顶点构成的几何体是立方体,故答案为:立方体;
②该晶胞中黑色小球个数是8、灰色小球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,二者个数变为为8:4=2:1,该化合物中一种元素化合价为+1价、一种为-2价,O为-2价、Na为+1价,所以化学式为Na2O,晶胞体积=$\frac{\frac{M}{{N}_{A}}×4}{ρ}$=$\frac{62×4}{ρ{N}_{A}}$cm3,晶胞边长=$\root{3}{V}$=$\root{3}{\frac{62×4}{ρ{N}_{A}}}$cm=$\root{3}{{\frac{248}{{ρ•{N_A}}}}}$cm,故答案为:$\root{3}{{\frac{248}{{ρ•{N_A}}}}}$.
点评 本题考查位置结构和性质,涉及晶胞计算、配合物、原子核外电子排布、氢键等知识点,这些都是高频考点,难点是晶胞计算,知道密度公式中各个字母含义,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 向煤中加入适量CaSO4,可大大减少烟气中的SO2 | |
| B. | 为保证加酶洗衣粉的洗涤效果,应用温水溶解洗衣粉 | |
| C. | 明矾水解形成的胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 光导纤维在信息领域应用越来越广泛,光纤的主要成分是SiO2 |
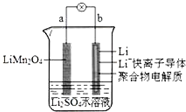
| A. | a为电池的负极 | |
| B. | 放电时,溶液中的Li+从a向b迁移 | |
| C. | 放电时,a极锂元素的化合价发生变化 | |
| D. | 电池充电反应为LiMn2O4=Li1-xMn2O4+xLi |
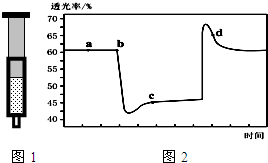 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是拉伸注射器 | |
| B. | d 点:v(正)<v(逆) | |
| C. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
| A. | 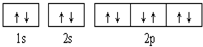 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 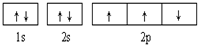 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 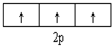 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
| A. | 每一个水分子内平均含有两个氢键 | |
| B. | 氢键与配位键一样,也是共价键的一种 | |
| C. | 氢键是导致浓硫酸具有粘稠性原因之一 | |
| D. | 由于H2O中含有氢键,因此水是一种非常稳定的化合物 |
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定温度下,已知0.1 mol•L-1 的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
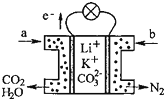 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )| A. | 此电池在常温时也能工作 | |
| B. | 正极电极反应式为:O2+2CO2+4e-=2CO32- | |
| C. | CO32-向正极移动 | |
| D. | a为CH4,b为CO2 |
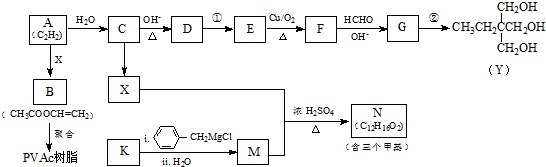
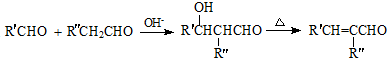
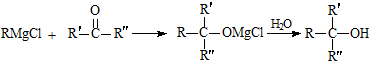
 .
. .
.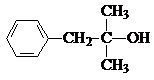 .
. .
.