题目内容
6.周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子.请填写下列空白.(1)e元素基态原子的核外电子排布式为1s22s22p63s23p63d104s1.
(2)b、c、d三种元素的第一电离能数值由大到小的顺序为N>O>S(填元素符号),其原因是同一周期,随着原子序数的增加,元素的第一电离能呈现逐渐增大的趋势,但氮元素的最外层电子达到半充满的稳定构型,其第一电离能大于氧元素,同主族自上而下,元素第一电离能减小,氧元素第一电离能大于硫元素.
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为sp3;分子中既含有极性共价键,又含有非极性共价键的化合物是H2O2、N2H4(填化学式,写出两种).
(4)已知c、e能形成晶胞如图甲和图乙所示的两种化合物,化合物的化学式为分别为:甲CuO,乙Cu2O;甲高温易转化为乙的原因是Cu2O中Cu的d轨道为全充满状态,较稳定.
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图丙所示).该化合物中,阴离子为SO42-,该化合物加热时首先失去的组分是H2O,判断理由是H2O和Cu2+的配位键比NH3与Cu2+的弱.

分析 周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素;c的最外层电子数为其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故c是O元素;d与c同族,则d是S元素;b的价电子层中的未成对电子有3个,且原子序数小于氧,外围电子排布为2s22p3,则b是N元素;e的最外层只有一个电子,但次外层有18个电子,只能处于第四周期,核外电子数为2+8+18+1=29,为Cu元素,据此解答.
解答 解:周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素;c的最外层电子数为其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故c是O元素;d与c同族,则d是S元素;b的价电子层中的未成对电子有3个,且原子序数小于氧,外围电子排布为2s22p3,则b是N元素;e的最外层只有一个电子,但次外层有18个电子,只能处于第四周期,核外电子数为2+8+18+1=29,为Cu元素.
(1)e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素,基态原子核外电子排布为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)b、c、d分别是N、O、S元素,同一周期,随着原子序数的增加,元素的第一电离能呈现逐渐增大的趋势,但氮元素的最外层电子达到半充满的稳定构型,其第一电离能大于氧元素,同主族自上而下,元素第一电离能减小,氧元素第一电离能大于硫元素,所以N、O、S中第一电离能从大到小的顺序为:N>O>S,
故答案为:N>O>S;同一周期,随着原子序数的增加,元素的第一电离能呈现逐渐增大的趋势,但氮元素的最外层电子达到半充满的稳定构型,其第一电离能大于氧元素,同主族自上而下,元素第一电离能减小,氧元素第一电离能大于硫元素;
(3)a是H元素,a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子为NH3,氨气分子中氮原子含有3个共价键和一个孤电子对,所以该分子的中心原子的杂化方式为sp3;分子中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4,
故答案为:sp3;H2O2、N2H4;
(4)O、Cu形成的化合物,晶胞甲中,白色球数目=1+8×$\frac{1}{8}$+2×$\frac{1}{2}$+4×$\frac{1}{4}$=4,黑色球数目为4,故该晶体中Cu、O原子数目之比为1:1,该化合物为CuO;晶胞乙中白色球数目=1+8×$\frac{1}{8}$=2,黑色球数目为4,为A2B型,故该化合物化学式为Cu2O;Cu2O中Cu的d轨道为全充满状态,较稳定,CuO高温易转化为Cu2O,
故答案为:CuO;Cu2O;Cu2O中Cu的d轨道为全充满状态,较稳定;
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明该阴离子价层电子对个数是4且不含孤电子对,应为SO42-;
阳离子呈轴向狭长的八面体结构(如图2所示),阳离子为Cu2+,配位数是6,在八面体上下顶点上分子含有两个共价键且含有两个孤电子对,为H2O分子,有2个,正方形平面上四个顶点上分子含有3个共价键且含有一个孤电子对,所以为NH3分子,有4个,其化学式为[Cu(NH3)4(H2O)2]SO4,H2O和Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O,
故答案为:SO42-;H2O;H2O和Cu2+的配位键比NH3与Cu2+的弱.
点评 本题是对物质结构和性质的考查,涉及电离能、核外电子排布、分子结构、晶胞计算、配合物等知识点,对于分子空间结构,采取逆向形式进行考查,具有一定的开放性,增大题目难度.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | 同系物官能团的种类与个数必须相同 | |
| B. | 相邻两个同系物的相对分子质量相差14 | |
| C. | 通式相同的有机物一定互为同系物 | |
| D. | 同系物具有相似的化学性质 |
| A. | 生成SO3 2mol | |
| B. | SO2和SO3物质的量之和一定为2mol | |
| C. | 反应放出197kJ的热量 | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
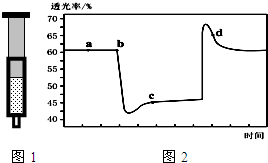 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是拉伸注射器 | |
| B. | d 点:v(正)<v(逆) | |
| C. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
| A. | 直线 sp杂化 | B. | V型 sp2杂化 | ||
| C. | 三角锥形 sp3杂化 | D. | 平面三角形 sp2 杂化 |
| A. | 任何化学反应的限度都相同 | |
| B. | 可以通过改变温度控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到最大限度时,反应速率也最大 |

 X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q是原子序数依次增大的前四周期元素.已知X、Y、Z、W均为非金属元素,X的基态原子由2个未成对电子,XW2分子与Y3为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: ;
;