题目内容
1.甲、乙、丙三种含不相同离子的可溶性强电解质,它们所含的离子如下表所示:| 阳离子 | NH4+、Na+、Mg2+ |
| 阴离子 | OH-、NO3-、SO42- |
则乙物质( )
| A. | 可能是Na2S04 | B. | 可能是NH4NO3 | C. | 可能是NaOH | D. | 一定不是(NH4)2SO4 |
分析 甲、乙、丙均是可溶性强电解质,则OH-只能与Na+组成NaOH,三种化合物不含相同离子,所以甲、乙、丙化合物有两种组合,第一组:NaOH、(NH4)2SO4、Mg(NO3)2;第二组:NaOH、NH4NO3、MgSO4,根据溶质质量相等,溶液体积相等以及物质的量浓度大小判断,相对分子质量:Mr(丙)>Mr(乙)>Mr(甲),据此判断.
解答 解:甲、乙、丙都是可溶性强电解质,则OH-只能与Na+组成NaOH,三种化合物不含相同离子,所以甲、乙、丙化合物有两种组合:NaOH、(NH4)2SO4、Mg(NO3)2或NaOH、NH4NO3、MgSO4,根据溶质质量相等,溶液体积相等以及物质的量浓度大小判断,相对分子质量:Mr(丙)>Mr(乙)>Mr(甲).
第一种情况:NaOH、(NH4)2SO4、Mg(NO3)2,NaOH相对分子质量为40,(NH4)2SO4相对分子质量为132、Mg(NO3)2相对分子质量为148,
第二种情况:NaOH、NH4NO3、MgSO4,NaOH相对分子质量为40、NH4NO3相对分子质量为80、MgSO4相对分子质量为120.
所以甲为NaOH,乙可能是(NH4)2SO4或NH4NO3,丙为Mg(NO3)2或MgSO4,
故选B.
点评 本题考查离子共存、物质的量浓度有关计算等,难度中等,明确根据离子共存判断其中一种为氢氧化钠、再进行讨论可能的物质是关键.

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
11.已知下列反应的反应热:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
| A. | -870.3 kJ/mol | B. | -571.6 kJ/mol | C. | +787.0 kJ/mol | D. | -488.3 kJ/mol |
12.已知乙炔(C2H2)、苯(C6H6)、苯酚(C6H6O)的混合气体中含氢元素的质量分数为7%,则混合气体中氧元素的质量分数为( )
| A. | 83% | B. | 24% | C. | 68% | D. | 9% |
16.下列关于同系物的叙述不正确的是( )
| A. | 同系物官能团的种类与个数必须相同 | |
| B. | 相邻两个同系物的相对分子质量相差14 | |
| C. | 通式相同的有机物一定互为同系物 | |
| D. | 同系物具有相似的化学性质 |
6.下列有关生活、社会中的化学,说法不正确的是( )
| A. | 向煤中加入适量CaSO4,可大大减少烟气中的SO2 | |
| B. | 为保证加酶洗衣粉的洗涤效果,应用温水溶解洗衣粉 | |
| C. | 明矾水解形成的胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 光导纤维在信息领域应用越来越广泛,光纤的主要成分是SiO2 |
13.下列各装置能偶构成原电池的是( )
| A. | 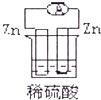 | B. | 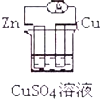 | ||
| C. | 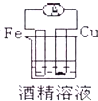 | D. | 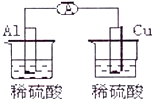 |
10.下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A. | 铝片和稀盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 酒精在氧气中的燃烧 | D. | 灼热的碳与水蒸汽的反应 |
11.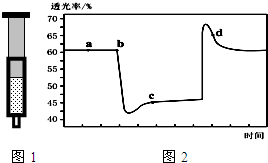 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是拉伸注射器 | |
| B. | d 点:v(正)<v(逆) | |
| C. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |