题目内容
2.下列对相应实验现象的描述不正确的是( )| A. | 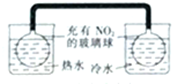 左边玻璃球内气体颜色更浅 | B. | 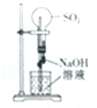 挤压胶头滴管产生喷泉现象 | ||
| C. | 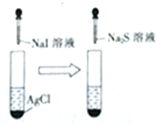 白色沉淀先变黄色再变黑色 | D. | 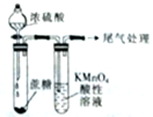 酸性高锰酸钾溶液褪色或变浅 |
分析 A.存在2NO2(红棕色)?N2O4(g)△H<0;
B.二氧化硫易与NaOH溶液反应,气体减少;
C.发生沉淀的转化;
D.浓硫酸使蔗糖碳化,然后C与浓硫酸反应生成二氧化硫,二氧化硫与高锰酸钾发生氧化还原反应.
解答 解:A.存在2NO2(红棕色)?N2O4(g)△H<0,温度升高,平衡逆向移动,则左边玻璃球内气体颜色加深,故A错误;
B.二氧化硫易与NaOH溶液反应,气体减少,则挤压胶头滴管,打破压强平衡,产生喷泉现象,故B正确;
C.AgCl转化为AgI,再转化为Ag2S,发生沉淀的转化,观察到白色沉淀先变黄色再变黑色,故C正确;
D.浓硫酸使蔗糖碳化,然后C与浓硫酸反应生成二氧化硫,二氧化硫与高锰酸钾发生氧化还原反应,则酸性高锰酸钾溶液褪色或变浅,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高考常见题型,涉及化学平衡及移动、喷泉实验、沉淀转化、氧化还原反应等等,把握物质的性质、反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
12.已知乙炔(C2H2)、苯(C6H6)、苯酚(C6H6O)的混合气体中含氢元素的质量分数为7%,则混合气体中氧元素的质量分数为( )
| A. | 83% | B. | 24% | C. | 68% | D. | 9% |
13.下列各装置能偶构成原电池的是( )
| A. | 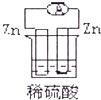 | B. | 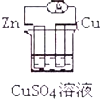 | ||
| C. | 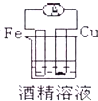 | D. | 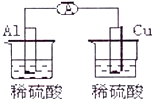 |
10.下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A. | 铝片和稀盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 酒精在氧气中的燃烧 | D. | 灼热的碳与水蒸汽的反应 |
17.一定温度下.将2molSO2和1molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
| A. | 生成SO3 2mol | |
| B. | SO2和SO3物质的量之和一定为2mol | |
| C. | 反应放出197kJ的热量 | |
| D. | SO2的物质的量和SO3物质的量一定相等 |
11.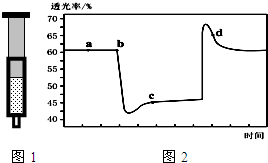 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是拉伸注射器 | |
| B. | d 点:v(正)<v(逆) | |
| C. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
12.下列关系的比较中,正确的是( )
| A. | 离子半径:K+>Mg2+>Na+ | |
| B. | 热稳定性:NaHCO3>Na2CO3>H2CO3 | |
| C. | 结合H+的能力:OH->ClO->HCO3- | |
| D. | 相同pH的HCl和CH3COOH加水稀释相同倍数,pH:CH3COOH>HCl |
 .
. .
.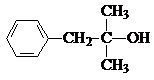 .
. .
.