题目内容
1. 下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
下表是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(2)在元素 ①~⑧中,原子半径最大的是钠(填元素名称).
(3)元素⑤⑥⑦的最高价氧化物对应水化物,按碱性从强到弱的排列顺序是NaOH>Mg(OH)2>Al(OH)3(用化学式表示).
(4)用电子式表示元素①和⑧组成的化合物的形成过程
 .
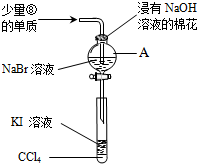
.(5)为验证VIIA族部分元素非金属性的递变规律,设计了如图装置进行实验,请回答:
①仪器A的名称是分液漏斗,A中发生的反应的离子方程式是2Br-+Cl2=Br2+2Cl-.
②棉花中浸有的NaOH溶液的作用是(用离子方程式表示)Cl2+2OH-=Cl-+ClO-+H2O.
③为验证溴与碘非金属性强弱:通入少量⑧的单质,充分反应后,将A中液体滴入试管内,取下试管,充分振荡、静置,可观察到溶液分层,上层几乎无色,下层呈紫红色.
④VIIA族元素,非金属性随元素核电荷数增加而逐渐减弱的原因:同主族元素从上到下,电子层数增多,原子半径逐渐增大,得电子能力逐渐减弱.
分析 由元素在周期表中位置,可知①为H、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al,⑧为Cl,
(1)上述元素中,F的得电子能力最强;
(2)电子层越多,原子半径越大;相同电子层,原子序数小的原子半径大;
(3)金属性越强,则最高价氧化物对应水化物的碱性越强;
(4)①和⑧组成的化合物为HCl,为共价化合物;
(5)①由图可知,A为分液漏斗,A中发生氯气与NaBr的氧化还原反应;
②棉花中浸有的NaOH溶液可吸收氯气,防止氯气扩散到空气中;
③溴与KI反应生成碘,碘易溶于四氯化碳;
④同主族元素从上到下,电子层、原子半径均增大,得到电子能力减弱.
解答 解:由元素在周期表中位置,可知①为H、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al,⑧为Cl,
(1)上述元素中,F的得电子能力最强,则F的非金属性最强,故答案为:F;
(2)电子层越多,原子半径越大;相同电子层,原子序数小的原子半径大,则钠的原子半径最大,故答案为:钠;
(3)金属性Na>Mg>Al,则最高价氧化物对应水化物的碱性为NaOH>Mg(OH)2>Al(OH)3,故答案为:NaOH>Mg(OH)2>Al(OH)3;
(4)①和⑧组成的化合物为HCl,为共价化合物,用电子式表示其形成过程为 ,
,
故答案为: ;
;
(5)①由图可知,A为分液漏斗,A中发生氯气与NaBr的氧化还原反应,该离子反应为2Br-+Cl2=Br2+2Cl-,故答案为:分液漏斗;2Br-+Cl2=Br2+2Cl-;
②棉花中浸有的NaOH溶液可吸收氯气,防止氯气扩散到空气中,发生的离子反应为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
③溴与KI反应生成碘,碘易溶于四氯化碳,充分振荡、静置,可观察到溶液分层,上层几乎无色,下层呈紫红色,故答案为:溶液分层,上层几乎无色,下层呈紫红色;
④综上所述,由实验可知同主族元素从上到下,电子层数增多,原子半径逐渐增大,得到电子能力减弱,非金属性随元素核电荷数增加而逐渐减弱,
故答案为:电子层数增多,原子半径逐渐增大.
点评 本题考查位置、结构及性质的关系及应用,为高频考点,把握元素的位置、性质及元素化合物知识为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案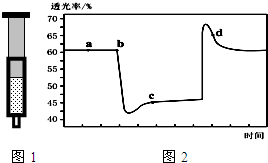 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,图1和图2是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是拉伸注射器 | |
| B. | d 点:v(正)<v(逆) | |
| C. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
| A. | 离子半径:K+>Mg2+>Na+ | |
| B. | 热稳定性:NaHCO3>Na2CO3>H2CO3 | |
| C. | 结合H+的能力:OH->ClO->HCO3- | |
| D. | 相同pH的HCl和CH3COOH加水稀释相同倍数,pH:CH3COOH>HCl |
(1)当用含NaOH物质的量为3mol的溶液,吸收标准状况下44.8L SO2时,溶液中的溶质为Na2SO3、NaHSO3.
(2)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②NaHSO3溶液中所含离子的浓度由大到小的顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
③当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):ab.
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
| A. | 任何化学反应的限度都相同 | |
| B. | 可以通过改变温度控制化学反应的限度 | |
| C. | 可以通过延长化学反应的时间改变化学反应的限度 | |
| D. | 当一个化学反应在一定条件下达到最大限度时,反应速率也最大 |
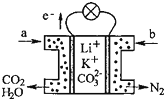 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见如图.下列说法正确的是( )| A. | 此电池在常温时也能工作 | |
| B. | 正极电极反应式为:O2+2CO2+4e-=2CO32- | |
| C. | CO32-向正极移动 | |
| D. | a为CH4,b为CO2 |
| A. | 同一原子中,2p、3p、4p能级的轨道数依次增多 | |
| B. | 电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则 | |
| C. | 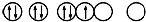 表示的原子能量处于最低状态 表示的原子能量处于最低状态 | |
| D. | 在离核最近区域内运动的电子能量最低 |
| A. | 阴、阳离子之间通过相互吸引作用形成的化学键叫离子键 | |
| B. | 根据电离方程式HCl=H++Cl-,可判断HC1分子里存在离子键 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 离子化合物一定由金属元素和非金属元素组成 |
| A. | CH4的沸点比SiH4低,而CH4比SiH4热稳定性强 | |
| B. | 有机物大多难溶于水,而乙醇和乙酸可与水互溶 | |
| C. | H2O2和H2S的相对分子相近,而H2O2的沸点远高于H2S | |
| D. | 采用加压液化的方法从氨合成塔里分离出NH3 |