题目内容
【题目】铁黑(Fe3O4)是常见的铁系颜料。一种制取铁黑的实验流程如图所示:

制取铁黑的反应原理可表示为:![]()
(1)保存FeSO4溶液时,常在试剂瓶中加入铁粉,其目的是______________________________。
(2)加入氨水调pH时,发生反应的离子方程式_______________________________________。
(3)Fe(OH)2在空气被氧化为Fe(OH)3,写出反应的化学方程式为__________________________。
【答案】防止Fe2+被氧化为Fe3+ ![]()
![]()
【解析】
硫酸亚铁溶液中加入氨水,亚铁离子在碱性条件下与氢氧根离子反应生成白色的氢氧化亚铁,继续滴加氨水并通入空气,生成的氢氧化亚铁会很快被氧化,变成灰绿色,最终氢氧化亚铁会被氧化成红褐色的氢氧化铁沉淀,最后过滤、洗涤、干燥并加热,获得铁黑(Fe3O4),结合铁及其化合物的性质分析解答。
(1)FeSO4具有还原性,可被空气中氧气氧化生成硫酸铁,加入铁粉,能够将氧化生成的硫酸铁还原为硫酸亚铁,防止硫酸亚铁被氧化,故答案为:防止Fe2+被氧化为Fe3+
(2)在FeSO4溶液中,加入氨水调pH至7~9时,生成氢氧化亚铁沉淀时发生反应的离子方程式为Fe2++2NH3H2O=Fe(OH)2↓+2NH4+,故答案为:Fe2++2NH3H2O=Fe(OH)2↓+2NH4+;
(3)Fe(OH)2在空气被氧化为Fe(OH)3,反应的化学方程式为4Fe(OH)2 + O2+ 2H2O=4Fe(OH)3,故答案为:4Fe(OH)2 + O2+ 2H2O=4Fe(OH)3。

 名校课堂系列答案
名校课堂系列答案【题目】短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,回答下列问题:
A | B | |
C | D |
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1 mol气态氢化物对应的热量变化如下,其中能表示该主族第四周期元素的单质生成1 mol气态氢化物所对应的热量变化是______![]() 选填字母编号
选填字母编号![]() 。
。
![]() 吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。
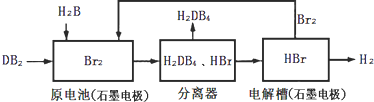
①查得:
化学键 | H-H | Br-Br | H-Br |
键能(kJ/mol) | 436 | 194 | 362 |
试写出通常条件下电解槽中发生总反应的热化学方程式:______。
②根据资料:
化学式 | Ag2SO4 | AgBr |
溶解度(g) | 0.796 | 8.4×10-6 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到______,证明分离效果较好。
③在原电池中,负极发生的反应式为______。
④在电解过程中,电解槽阴极附近溶液pH______(填“变大”、“变小”或“不变”)。
⑤将该工艺流程用总反应的化学方程式表示为:________,该生产工艺的优点有_____(答一点即可);缺点有____(答一点即可)。
(3)溴及化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入______,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为______。
(4)CuBr2分解的热化学方程式为:2CuBr2(s)![]() 2CuBr(s)+Br2(g)△H=+105.4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
2CuBr(s)+Br2(g)△H=+105.4kJ/mol。在密闭容器中将过量CuBr2于487K下加热分解,平衡时p(Br2)为4.66×103Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会______(填“增大”“不变”“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为______。







