题目内容
16.用浓盐酸和二氧化锰制氯气的实验装置如图所示: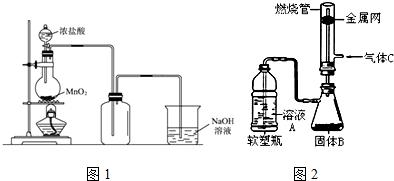
(1)制得的氯气中还含有氯化氢杂质,可通过装有饱和食盐水的洗气瓶除去.
(2)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气.用浓盐酸和高锰酸钾制氯气的反应方程式如下:2KMnO4+16HCl2KCl+2 MnCl2+5 Cl2+8 H2O
①配平该反应的化学方程式.
②当有1mol电子转移时,被氧化的HCl1mol,可生成气体(标准状态下)11.2 L.
(3)有人做了一个改进实验.挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并在管口点燃,可以看到可燃性气体C有明显的燃烧现象(金属网用以防止气体混合爆炸).用此装置模拟工业合成盐酸.则相应试剂选择正确的是c(选填序号).
| 溶液A | 固体B | 气体C | |
| a | 稀硫酸 | Zn | Cl2 |
| b | 浓盐酸 | MnO2 | H2 |
| C | 浓盐酸 | KMnO4 | H2 |
分析 (1)依据氯气在饱和食盐水 中溶解度不大,氯化氢易溶于水的性质解答;
(2)①反应中锰元素全部被还原,锰元素化合价由+7价降低为+2价,氯元素化合价由HCl中的-1升高为氯气中的0价,依据氧化还原反应得失电子数守恒、原子个数守恒书写方程式;
②依据方程式可知,没生成5mol氯气,有10mol氯化氢被氧化,转移10mol电子;
(3)根据物质间的反应结合试验装置来选择,依据氢气在纯净氯气中燃烧现象解答;
解答 解:(1)氯气在饱和食盐水 中溶解度不大,氯化氢易溶于水,混合气体通过盛有饱和食盐水的洗气瓶可以除去氯化氢杂质;
故答案为:饱和食盐水;
(2)①反应中锰元素全部被还原,锰元素化合价由+7价降低为+2价,氯元素化合价由HCl中的-1升高为氯气中的0价,要使氧化剂与还原剂得失电子守恒,高锰酸钾系数为2,氯气系数为5,反应中有10氯化氢被氧化,6mol氯化氢表现酸性,所以方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O;
故答案为:2;16; 2;2; 5;8;
②依据方程式可知,没生成5mol氯气,有10mol氯化氢被氧化,转移10mol电子,则当有1mol电子转移时,被氧化的HCl1mol,可生成氯化氢物质的量为0.5mol,(标准状态下)11.2L;
故答案为:1;11.2;
(3)a.装置中塑料瓶中的液体被挤压可以进入固体B中反应,生成一种密度小的气体氢气,才能使得燃烧反应在上方进行,所以a错误;
b.二氧化锰和浓盐酸的反应需加热才能发生,该装置不需要加热就能制备氯气,故b错误;
c.浓盐酸和高锰酸钾在不加热的条件下可以生成氯气,氯气和氢气燃烧可以获得氯化氢,燃烧时产生苍白色火焰,被水吸收而获得盐酸,故c正确;
氢气在纯净的氯气中燃烧生成氯化氢,发出苍白色的火焰,氯化氢极易溶于水,在管口上分与水蒸气结合成盐酸液滴,看到白雾产生;
故答案为:c; 苍白色火焰,管口上方有白雾.
点评 本题考查了氯气的制备、氧化还原反应、实验装置的分析,明确氯气制备原理、氯气性质是解题关键,侧重考查学生分析实验的能力,题目难度中等.

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案| A. | 质子数为7、中子数为7的氮原子:${\;}_{7}^{7}$N | |
| B. | 氮离子(N3-)的结构示意图: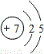 | |
| C. | 氨气分子的电子式: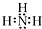 | |
| D. | 甘氨酸分子的结构简式:C2H5O2N |
| Na2CO3的质量 | 关于O2的描述 | |
| A | 21.2g | O2的摩尔质量是36g•mol-1 |
| B | 21.6g | 生成标准状况下O2的体积为2.24L |
| C | 21.6g | O2的摩尔质量是34g•mol-1 |
| D | 22.4g | 生成标准状况下O2的体积为2.24L |
| A. | A | B. | B | C. | C | D. | D |
| A. | H2O2、Na2O2都属于过氧化物、都存在非极性共价键 | |
| B. | H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同 | |
| C. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| D. | H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子 |
| A. | 用托盘天平称取25.20gNaOH | |
| B. | 将称好的NaOH固体放入容量瓶中加入少量水溶解 | |
| C. | 未冷却就将烧杯中的NaOH溶液注入容量瓶中会导致溶液浓度偏高 | |
| D. | 定容时,液面超过了容量瓶刻度线,用胶头滴管吸出刻度线以上的溶液 |
| A. | ①②③④ | B. | ③④②① | C. | ③②①④ | D. | ③①②④ |
| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 任何物质的摩尔质量就等于它的相对分子质量或相对原子质量 | |
| C. | 物质的量实质上是物质的质量 | |
| D. | 1mol H2SO4中含有2mol H、1mol S和4mol O |
 (1)一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志之一.请列举出乙烯的两种重要用途:①生产聚乙烯,②果实催熟;
(1)一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志之一.请列举出乙烯的两种重要用途:①生产聚乙烯,②果实催熟;