题目内容
6.下列叙述正确的是( )| A. | 摩尔是国际科学界建议采用的一种物理量 | |
| B. | 任何物质的摩尔质量就等于它的相对分子质量或相对原子质量 | |
| C. | 物质的量实质上是物质的质量 | |
| D. | 1mol H2SO4中含有2mol H、1mol S和4mol O |
分析 A.物质的量是一种基本物理量,单位是摩尔;
B.从摩尔质量概念分析,单位物质的量的物质的质量即1mol物质的质量;
C.物质的量和物质的质量是不同的物理量;
D.化学式中元素右下角的数字表示一个分子中所含有的原数目.
解答 解:A.摩尔是物质的量的单位,故A错误;
B.摩尔质量单位是g/mol,数值上等于物质的相对分子质量或相对原子质量,故B错误;
C.物质的量单位为mol,而物质的质量的单位为g,二者是不同的物理量,故C错误;
D.1个H2SO4分子中含有4个氧原子,2个氢原子和1个硫原子,故D正确.
故选D.
点评 本题考查了物质的量、摩尔质量的概念和单位、分子中原子个数的计算,难度不大,要注意物质的量与粒子数之间的关系.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
16.用浓盐酸和二氧化锰制氯气的实验装置如图所示:
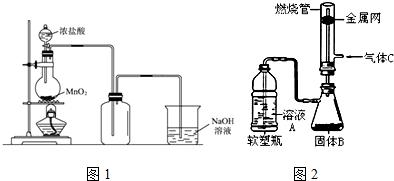
(1)制得的氯气中还含有氯化氢杂质,可通过装有饱和食盐水的洗气瓶除去.
(2)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气.用浓盐酸和高锰酸钾制氯气的反应方程式如下:2KMnO4+16HCl2KCl+2 MnCl2+5 Cl2+8 H2O
①配平该反应的化学方程式.
②当有1mol电子转移时,被氧化的HCl1mol,可生成气体(标准状态下)11.2 L.
(3)有人做了一个改进实验.挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并在管口点燃,可以看到可燃性气体C有明显的燃烧现象(金属网用以防止气体混合爆炸).用此装置模拟工业合成盐酸.则相应试剂选择正确的是c(选填序号).
管口可观察到的现象是苍白色火焰,管口上方有白雾.

(1)制得的氯气中还含有氯化氢杂质,可通过装有饱和食盐水的洗气瓶除去.
(2)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气.用浓盐酸和高锰酸钾制氯气的反应方程式如下:2KMnO4+16HCl2KCl+2 MnCl2+5 Cl2+8 H2O
①配平该反应的化学方程式.
②当有1mol电子转移时,被氧化的HCl1mol,可生成气体(标准状态下)11.2 L.
(3)有人做了一个改进实验.挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并在管口点燃,可以看到可燃性气体C有明显的燃烧现象(金属网用以防止气体混合爆炸).用此装置模拟工业合成盐酸.则相应试剂选择正确的是c(选填序号).
| 溶液A | 固体B | 气体C | |
| a | 稀硫酸 | Zn | Cl2 |
| b | 浓盐酸 | MnO2 | H2 |
| C | 浓盐酸 | KMnO4 | H2 |
17.对于氮、磷、砷元素的下列说法中,正确的是( )
| A. | 最高价氧化物的水化物酸性减弱的顺序是HNO3、H3PO4、H3AsO4 | |
| B. | 气态氢化物的水溶液碱性增强的顺序是NH3、PH3、AsH3 | |
| C. | 随着核电荷数的增大,其原子半径减小 | |
| D. | 随原子序数增大,气态氢化物的稳定性增强 |
14.化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
| A. | 常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为H2O>NO>CO2 | |
| B. | 常温下,NO分解产生O2的反应的平衡常数表达式为K1=[N2]•[O2] | |
| C. | 常温下,2H2O(g)═2H2 (g)+O2(g),此时平衡常数的数值约为5×10-82 | |
| D. | 以上说法都不正确 |
1.用2-丁炔为原料制取CH3CHBrCBrClCH3,可行的反应途径是( )
| A. | 先加Cl2,再加Br2 | B. | 先加Cl2,再加HBr | C. | 先加HCl,再加HBr | D. | 先加HCl,再加Br2 |
18.运动会发令枪中火药被撞击时发生的反应是5KClO3+6P═3P2O5+5KCl.关于该反应,下列说法正确的是( )
| A. | 反应中P得到电子 | |
| B. | 消耗1mol KClO3时,转移5mol 电子 | |
| C. | 发令时看到白烟可能是P2O5固体颗粒 | |
| D. | 氧化剂与还原剂的物质的量比为6:5 |
15.实验室制取Cl2的反应为:MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,下列说法正确的是( )
| A. | 氧化剂是HCl,还原剂是MnO2 | |
| B. | 每生成2 mol Cl2,转移电子的物质的量是4 mol | |
| C. | 每消耗1 mol MnO2,表现还原作用的HCl为4 mol | |
| D. | Cl2既是氧化产物又是还原产物 |
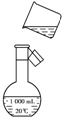 实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.
实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.