题目内容
1. (1)一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志之一.请列举出乙烯的两种重要用途:①生产聚乙烯,②果实催熟;
(1)一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志之一.请列举出乙烯的两种重要用途:①生产聚乙烯,②果实催熟;(2)实验室可用如图所示装置制取乙烯,A中加入的两种试剂是浓硫酸和乙醇,它们的体积比约为3:1.反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;乙烯的收集方法为排水集气法;
(3)将反应产生的乙烯通入酸性高锰酸钾溶液中,观察到的现象是紫色高锰酸钾溶液褪色;将反应产生的乙烯通入溴的四氯化碳溶液中,观察到的现象是溴的四氯碳溶液褪色;
(4)反应进行一段时间后,A中混合液常变黑,并有刺激性气味的气体生成,它对乙烯性质的检验有干扰;请设计实验验证该气体的存在,并最后排除该气体对乙烯性质的干扰.(只要求画出装置图和标明各仪器中的药品,并标明气流的方向)
分析 (1)乙烯是一种植物生长调节剂;乙烯能够聚合生成聚乙烯;
(2)乙醇在浓硫酸做催化剂、脱水剂条件下,加热到170度发生消去反应生成乙烯,浓硫酸与乙醇体积比为:3:1;以及乙烯密度与空气密度相差不大,难溶于水选择收集方法;
(3)乙烯含有碳碳双键具有还原性,能够发生加成反应;
(4)依据反应进行一段时间后,A中混合液常变黑,并有刺激性气味的气体生成,二氧化硫为酸性气体,可与碱反应,可使品红褪色,具有还原性,可与酸性高锰酸钾发生氧化还原反应,而乙烯含有碳碳双键可与酸性高锰酸钾发生氧化还原反应,根据二氧化硫和乙烯的性质的异同设计检验方案.
解答 解:(1)乙烯是一种植物生长调节剂;乙烯能够聚合生成聚乙烯;
故答案为:①生产聚乙烯,②果实催熟;
(2)乙烯在浓硫酸做催化剂、脱水剂条件下,加热到170度发生消去反应生成乙烯,化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;浓硫酸与乙醇体积比为:3:1;乙烯密度与空气密度相差不大,难溶于水,应选择排水法收集;
故答案为:浓硫酸和乙醇;3:1;CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;排水集气法;
(3)乙烯含有碳碳双键具有还原性,能够被酸性高锰酸钾氧化使高锰酸钾褪色;
能够与溴发生加成反应,使溴的四氯化碳褪色;
故答案为:紫色高锰酸钾溶液褪色; 溴的四氯碳溶液褪色;
(4)依据题意可知生成的乙烯中含有二氧化硫,二氧化硫为酸性气体,可与碱反应,可使品红褪色,具有还原性,可与酸性高锰酸钾发生氧化还原反应,而乙烯含有碳碳双键可与酸性高锰酸钾发生氧化还原反应,所以应先用品红溶液检验二氧化硫的存在,然后用氢氧化钠溶液吸收二氧化硫,再通过品红溶液检验二氧化硫是否被除尽,最后通入酸性的高锰酸钾溶液,观察是否褪色,装置图为: ;
;
故答案为: .
.
点评 本题考了乙烯的实验室制法以及产物的检验,明确制备原理和乙烯的性质是解题关键,注意实验设计的严密性,题目难度中等.

| A. | FeS2$\stackrel{O_{2}/高温}{→}$SO2$\stackrel{H_{2}O_{2}(aq)}{→}$H2SO4 | |
| B. | 饱和NaCl溶液$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | CuSO4(aq)$\stackrel{过量NaOH(aq)}{→}$Cu(OH)2$\stackrel{葡萄糖(aq)/△}{→}$Cu2O | |
| D. | 1 mol•L-1HCl(aq)$\stackrel{MnO_{2}/△}{→}$Cl2$\stackrel{石灰乳}{→}$Ca(ClO)2 |
| A. | 硫酸,二氧化硫 | B. | BaCO3,氨水 | C. | 盐酸,酒精 | D. | 熔融的氯化钾,水 |
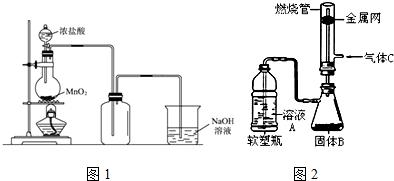
(1)制得的氯气中还含有氯化氢杂质,可通过装有饱和食盐水的洗气瓶除去.
(2)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气.用浓盐酸和高锰酸钾制氯气的反应方程式如下:2KMnO4+16HCl2KCl+2 MnCl2+5 Cl2+8 H2O
①配平该反应的化学方程式.
②当有1mol电子转移时,被氧化的HCl1mol,可生成气体(标准状态下)11.2 L.
(3)有人做了一个改进实验.挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并在管口点燃,可以看到可燃性气体C有明显的燃烧现象(金属网用以防止气体混合爆炸).用此装置模拟工业合成盐酸.则相应试剂选择正确的是c(选填序号).
| 溶液A | 固体B | 气体C | |
| a | 稀硫酸 | Zn | Cl2 |
| b | 浓盐酸 | MnO2 | H2 |
| C | 浓盐酸 | KMnO4 | H2 |
| A. | 硫 | B. | 氧 | C. | 氮 | D. | 铝 |
| A. | 溴单质 | B. | 硫化氢 | C. | 品红 | D. | 氢氧化钙 |
①大气固氮
②硝酸银分解
③实验室制取氨气.
| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ③①② |
 实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.
实验室用氢氧化钠固体配制0.10mol•L-1的CuSO4溶液480mL,回答下列问题.