题目内容
5.某有机物X的通式为CnH2nO2,经质谱法测定相对分子质量Mr介于88与116之间,经红外光谱测定,X分子含1个碳氧双键. 请回答下列问题:(1)X的摩尔质量为102g/mol.X可能的官能团名称为羧基或酯基等.
(2)若X能与碳酸氢钠溶液反应产生气泡且在核磁共振氢谱上只有2个吸收峰,则X的结构简式为(CH3)3CCOOH.
(3)若X能与氢氧化钠溶液反应,但不能与碳酸氢钠反应,则X的结构有9种.
(4)若X能在稀硫酸中水解生成两类有机物A、B,在一定条件A与B重新反应生成的酯类有机物最多有40种.
分析 (1)某有机物X的通式为CnH2nO2,相对分子质量Mr介于88与116之间,则88<14n+32<116,故4<n<6,则n=5,其分子式为C5H10O2,X分子含有1个碳氧双键,可能含有羧基或酯基等;
(2)若X能与碳酸氢钠溶液反应产生气泡,则X含有羧基,且在核磁共振氢谱上只有2个吸收峰,羧基连接的碳原子上同时连接3个-CH3;
(3)若X能与氢氧化钠溶液反应,但不能与碳酸氢钠反应,X属于酯类;
(4)若X能在稀硫酸中水解生成两类有机物A、B,则X为酯类,根据醇与羧酸之间组合判断确定A与B重新反应生成的酯类物质种类.
解答 解:(1)某有机物X的通式为CnH2nO2,相对分子质量Mr介于88与116之间,则88<14n+32<116,故4<n<6,则n=5,其分子式为C5H10O2,X的摩尔质量为102g/mol,X分子含1个碳氧双键,可能含有羧基或酯基等,故答案为:102g/mol;羧基或酯基等;
(2)若X能与碳酸氢钠溶液反应产生气泡,则X含有羧基,且在核磁共振氢谱上只有2个吸收峰,羧基连接的碳原子上同时连接3个-CH3,X的结构简式为(CH3)3CCOOH,故答案为:(CH3)3CCOOH;
(3)若X能与氢氧化钠溶液反应,但不能与碳酸氢钠反应,X属于酯类,
若为甲酸与丁醇形成的酯,丁醇有4种,故有4种结构;
若为乙酸与丙醇形成的酯,丙醇有2种,故有2种结构;
若为丙酸与乙醇形成的酯,只有一种结构;
若为丁酸与甲醇形成的酯,丁酸有2种,故有2种结构,
故符合条件的X的结构共有9种,
故答案为:9;
(4)若X能在稀硫酸中水解生成两类有机物A、B,则X为酯类,由(3)中分析可知,得到的醇有8种,得到的羧酸有5种,醇与羧酸之间重新反应生成的酯类物质最多有8×5=40种,
故答案为:40.
点评 本题考查有机物分子式确定、限制条件同分异构体书写等,关键是计算确定有机物分子式,难度中等.

| A. | 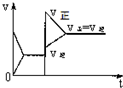 | B. | 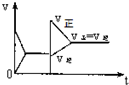 | C. | 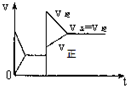 | D. | 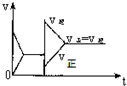 |
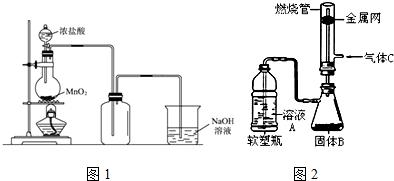
(1)制得的氯气中还含有氯化氢杂质,可通过装有饱和食盐水的洗气瓶除去.
(2)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气.用浓盐酸和高锰酸钾制氯气的反应方程式如下:2KMnO4+16HCl2KCl+2 MnCl2+5 Cl2+8 H2O
①配平该反应的化学方程式.
②当有1mol电子转移时,被氧化的HCl1mol,可生成气体(标准状态下)11.2 L.
(3)有人做了一个改进实验.挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并在管口点燃,可以看到可燃性气体C有明显的燃烧现象(金属网用以防止气体混合爆炸).用此装置模拟工业合成盐酸.则相应试剂选择正确的是c(选填序号).
| 溶液A | 固体B | 气体C | |
| a | 稀硫酸 | Zn | Cl2 |
| b | 浓盐酸 | MnO2 | H2 |
| C | 浓盐酸 | KMnO4 | H2 |
| A. | 溴单质 | B. | 硫化氢 | C. | 品红 | D. | 氢氧化钙 |
①大气固氮
②硝酸银分解
③实验室制取氨气.
| A. | ①②③ | B. | ②①③ | C. | ③②① | D. | ③①② |
| A. | 最高价氧化物的水化物酸性减弱的顺序是HNO3、H3PO4、H3AsO4 | |
| B. | 气态氢化物的水溶液碱性增强的顺序是NH3、PH3、AsH3 | |
| C. | 随着核电荷数的增大,其原子半径减小 | |
| D. | 随原子序数增大,气态氢化物的稳定性增强 |
2NO(g)?N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)?2H2O(g) K2=2×1081
2CO2(g)?2CO(g)+O2(g) K3=4×10-92
以下说法正确的是( )
| A. | 常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为H2O>NO>CO2 | |
| B. | 常温下,NO分解产生O2的反应的平衡常数表达式为K1=[N2]•[O2] | |
| C. | 常温下,2H2O(g)═2H2 (g)+O2(g),此时平衡常数的数值约为5×10-82 | |
| D. | 以上说法都不正确 |
| A. | 氧化剂是HCl,还原剂是MnO2 | |
| B. | 每生成2 mol Cl2,转移电子的物质的量是4 mol | |
| C. | 每消耗1 mol MnO2,表现还原作用的HCl为4 mol | |
| D. | Cl2既是氧化产物又是还原产物 |