题目内容
11.配制一定物质的量浓度的NaOH溶液,下面描述正确的是( )| A. | 用托盘天平称取25.20gNaOH | |
| B. | 将称好的NaOH固体放入容量瓶中加入少量水溶解 | |
| C. | 未冷却就将烧杯中的NaOH溶液注入容量瓶中会导致溶液浓度偏高 | |
| D. | 定容时,液面超过了容量瓶刻度线,用胶头滴管吸出刻度线以上的溶液 |
分析 A、托盘天平只能精确至0.1g;
B、容量瓶不能受热;
C、溶液会热胀冷缩;
D、用胶头滴管吸出溶液后,会连溶质一并吸出.
解答 解:A、托盘天平只能精确至0.1g,称量不出25.20g氢氧化钠固体,故A错误;
B、容量瓶不能受热,故不能用于溶解固体,故B错误;
C、溶液会热胀冷缩,待冷却后溶液的体积会低于刻度线,则浓度偏高,故C正确;
D、用胶头滴管吸出溶液后,会连溶质一并吸出,则溶液的浓度会偏小,故D错误.
故选C.
点评 本题考查了一定物质的量浓度溶液的配制过程中的仪器的使用和误差分析,难度不大,掌握公式的运用和配制原理是解题的关键.

练习册系列答案
相关题目
1.下列图示与对应的叙述相符的是( )
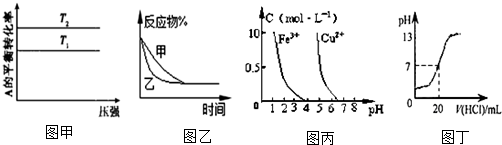

| A. | 图甲可以判断出反应 A(g)+B(g)?2C(g) 的△H<0,T2>T1 | |
| B. | 图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 | |
| C. | 据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH≈4.5 | |
| D. | 图丁表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入盐酸体积的变化 |
2.有机物X的键线式为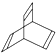 ,下列说法不正确的是( )
,下列说法不正确的是( )
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | X的化学式为C8H8 | |
| B. | X能使高锰酸钾酸性溶液褪色 | |
| C. | 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为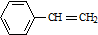 | |
| D. | X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有4种 |
19.常温,某稀氨水中的NH3.H2O电离达到平衡:NH3.H2O?NH4++OH-△H>0,下列叙述正确的是( )
| A. | 向其中加入NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| B. | 向其中加入NaHSO4固体,c(OH-)降低,Kw不变 | |
| C. | 向其中加入固体NH4Cl,平衡逆向移动,c(H+)降低 | |
| D. | 将水稀释,Kw不变,PH增大 |
16.用浓盐酸和二氧化锰制氯气的实验装置如图所示:
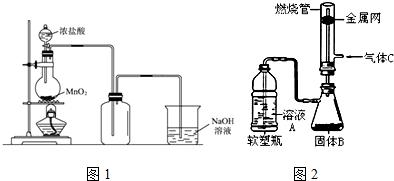
(1)制得的氯气中还含有氯化氢杂质,可通过装有饱和食盐水的洗气瓶除去.
(2)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气.用浓盐酸和高锰酸钾制氯气的反应方程式如下:2KMnO4+16HCl2KCl+2 MnCl2+5 Cl2+8 H2O
①配平该反应的化学方程式.
②当有1mol电子转移时,被氧化的HCl1mol,可生成气体(标准状态下)11.2 L.
(3)有人做了一个改进实验.挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并在管口点燃,可以看到可燃性气体C有明显的燃烧现象(金属网用以防止气体混合爆炸).用此装置模拟工业合成盐酸.则相应试剂选择正确的是c(选填序号).
管口可观察到的现象是苍白色火焰,管口上方有白雾.

(1)制得的氯气中还含有氯化氢杂质,可通过装有饱和食盐水的洗气瓶除去.
(2)二氧化锰和高锰酸钾都是强氧化剂,均可将浓盐酸氧化为氯气.用浓盐酸和高锰酸钾制氯气的反应方程式如下:2KMnO4+16HCl2KCl+2 MnCl2+5 Cl2+8 H2O
①配平该反应的化学方程式.
②当有1mol电子转移时,被氧化的HCl1mol,可生成气体(标准状态下)11.2 L.
(3)有人做了一个改进实验.挤压软塑料瓶,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并在管口点燃,可以看到可燃性气体C有明显的燃烧现象(金属网用以防止气体混合爆炸).用此装置模拟工业合成盐酸.则相应试剂选择正确的是c(选填序号).
| 溶液A | 固体B | 气体C | |
| a | 稀硫酸 | Zn | Cl2 |
| b | 浓盐酸 | MnO2 | H2 |
| C | 浓盐酸 | KMnO4 | H2 |
1.用2-丁炔为原料制取CH3CHBrCBrClCH3,可行的反应途径是( )
| A. | 先加Cl2,再加Br2 | B. | 先加Cl2,再加HBr | C. | 先加HCl,再加HBr | D. | 先加HCl,再加Br2 |
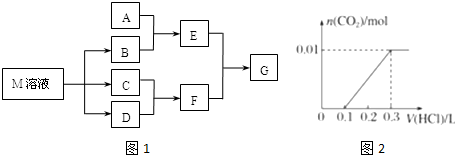
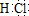 .
.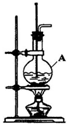 (1)在实验室制取乙烯的装置图(如图)中,A中加入的两种试剂是浓硫酸和乙醇,它们的体积比约为3:1;反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;乙烯的收集方法为排水集气法;
(1)在实验室制取乙烯的装置图(如图)中,A中加入的两种试剂是浓硫酸和乙醇,它们的体积比约为3:1;反应方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;乙烯的收集方法为排水集气法;