题目内容
9.芳香烃C8H10苯环上的一个H原子被-C3H6Cl取代,形成的同分异构体有(不考虑立体异构)( )| A. | 9种 | B. | 15种 | C. | 45种 | D. | 50种 |
分析 -C3H6Cl是用一个氯原子取代了丙基中的一个-H,故-C3H6Cl的结构有5种;分子式为C8H10的芳香烃,可能是乙苯,还可能是二甲苯,而根据2个甲基在苯环上的位置关系,可能是邻二甲苯、间二甲苯或对二甲苯,苯环的氢原子有几种,则被-C3H6Cl取代的位置就有几种,据此分析.
解答 解:-C3H6Cl是用一个氯原子取代了丙基中的一个-H,故-C3H6Cl的结构有5种:-CHClCH2CH3,-CH2CHClCH3,-CH2CH2CH2Cl,-CH(CH2Cl)CH3,-CCl(CH3)2.
分子式为C8H10的芳香烃,可能是乙苯、邻二甲苯、间二甲苯或对二甲苯.
若为乙苯,则苯环上打的氢原子有5种,则被-C3H6Cl取代的位置有3种,故所得的同分异构体为3×5=15种;
若为邻二甲苯,则苯环上的氢原子有2种,则被-C3H6Cl取代的位置有2种,故所得的同分异构体为2×5=10种;
若为间二甲苯,则苯环上的氢原子有3种,则被-C3H6Cl取代的位置有3种,故所得的同分异构体为3×5=15种;
若为对二甲苯,则苯环上的氢原子有1种,则被-C3H6Cl取代的位置有1种,故所得的同分异构体为1×5=5种;
故所得的同分异构体共有45种.
故选C.
点评 本题考查了同分异构体的书写,应注意的是物质中有几种氢原子,则一取代产物就有几种.难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
19.阿佛加德罗常数用NA表示,下列叙述正确的是( )
| A. | 室温时,1L pH=2的NH4Cl溶液中水电离出10-12 molH+ | |
| B. | 常温常压下,46g NO2含有的原子数等于3NA | |
| C. | 12g石墨含有4NA个自由移动的电子 | |
| D. | 22.4LCl2与足量NaOH反应,转移电子数NA |
1.如表是元素周期表的一部分,回答下列问题(答题时用具体元素符号表示).
(1)①、③形成的6原子气态化合物中含5个σ键,1个π键.
(2)元素⑨的原子核外次外层电子数为14个.焊接钢轨时,常利用元素⑨的氧化物与⑦的单质在高温下发生反应,写出其中一种反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(3)④、⑤两元素原子第一电离能较大的是N,两元素以质量比7:12组成的化合物A是一种高效火箭推进剂,相对分子质量为152,A的分子式为N4O6.
(4)⑥和⑧可形成某离子化合物,图1所示结构不能(选填“能”或“不能”)表示该离子化合物的晶胞;图1所示结构中,X离子的堆积方式为ABCABC…(选填“ABAB…”或“ABCABC…”).
(5)元素⑩单质的晶胞如图2所示,该晶胞中金属原子的配位数为12,每个晶胞“实际”拥有的原子数是4.

| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |
(2)元素⑨的原子核外次外层电子数为14个.焊接钢轨时,常利用元素⑨的氧化物与⑦的单质在高温下发生反应,写出其中一种反应的化学方程式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
(3)④、⑤两元素原子第一电离能较大的是N,两元素以质量比7:12组成的化合物A是一种高效火箭推进剂,相对分子质量为152,A的分子式为N4O6.
(4)⑥和⑧可形成某离子化合物,图1所示结构不能(选填“能”或“不能”)表示该离子化合物的晶胞;图1所示结构中,X离子的堆积方式为ABCABC…(选填“ABAB…”或“ABCABC…”).
(5)元素⑩单质的晶胞如图2所示,该晶胞中金属原子的配位数为12,每个晶胞“实际”拥有的原子数是4.

 .
. .
.
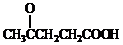 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):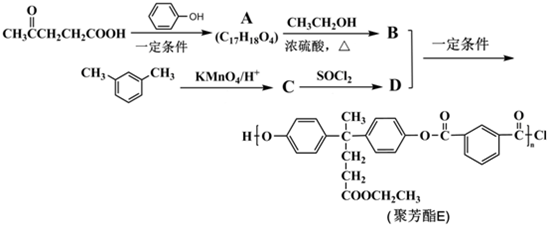
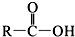 +SOCl2→
+SOCl2→ +SO2+HCl
+SO2+HCl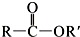 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)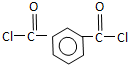 .
.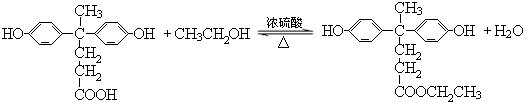 ,.
,.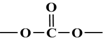 结构写出F与足量NaOH溶液共热反应的化学方程式:
结构写出F与足量NaOH溶液共热反应的化学方程式: .
.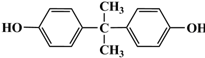 的路线.
的路线.
 (R、R′代表烃基)
(R、R′代表烃基)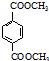 有多种同分异构体,同时满足下列条件的同分异构体有8种.
有多种同分异构体,同时满足下列条件的同分异构体有8种. .
.
 .
. .
.