题目内容
12. 海洋是巨大的资源宝库,具有美好的前景.
海洋是巨大的资源宝库,具有美好的前景.(1)“蛟龙”号潜水器通过机械手成功从海底取得“多金属结核”样本,样本含铁、锰等多种金属.基态锰原子的电子排布式为[Ar]3d54s2
(2)水溶液中,过硫酸盐可以将Mn2+ 氧化成MnO4-.H2S2O8的结构如图
 所示.
所示.①H2S2O8中硫原子的轨道杂化方式为sp3
②上述反应中被还原的元素为硫
③上述反应每生成1mol MnO4- 时,S2O82-断裂的键的类型是非极性共价键,数目为2.5NA
(3)海底还蕴藏着大量“可燃冰”.“可燃冰”实际上是由盛有甲烷、氮气、硫化氢等分子的水分子笼构成的水合物晶体.
①N、O、S三种元素第一电离能由大到小的顺序为N>O>S(填元素符号)
②一种甲烷水合物晶体中,平均每46个水分子构成8个笼,每个分子笼可容纳1个甲烷分子或水分子.若这8个分子笼中有6个容纳是甲烷分子,另外2个被水分子填充,这种可燃冰的平均组成可表示为CH4•8H2O.
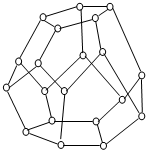
③水分子笼多种多样,如图是一种水分子笼的结构示意图(“O”表示水分子),其中包含的氢键数为30.
④实验测得冰中氢键的作用能为18.8kJ•mol-1,而冰的熔化热为5.0kJ•mol-1,其原因可能是液态水中仍然存在大量氢键.
分析 (1)锰原子序数为25,根据能量最低原则、泡利不相容原理和洪特规则综合考虑,写出核外电子排布式;
(2)①根据价层电子对=σ 键电子对+中心原子上的孤电子对,结合S2O8 2-结构判断杂化类型;
②氧化还原反应中,元素的化合价降低,被还原;
③活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键、同种非金属元素之间易形成非极性键,根据S2O8 2-结构分析解答;
(3)①同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;同主族从上到下,元素的第一电离逐渐减小;
②根据题中关于天然气水合物构成的描述,晶体中每8个笼中有6个容纳了CH4分子,另外2个被2个游离的H2O分子所填充,推断该天然气水合物的构成中CH4分子与H2O分子的粒子数的比,判断天然气水合物的平均组成的表示式;
③由此结构可知,此单元中含有水分子的个数为:20,其中每个水分子属于三个五元环,据此计算氢键;
④冰中氢键的作用能为18.8kJ•mol-1,而冰熔化热为5.0kJ•mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且液态水中仍在氢键.
解答 解:(1)锰原子序数为25,质子数为25,原子核外电子数为25,根据能量最低原则、泡利不相容原理和洪特规则,Mn的电子排布式为[Ar]3d54s2,
故答案为:[Ar]3d54s2;
(2)①H2S2O8中,硫原子价层电子对数=σ 键电子对+中心原子上的孤电子对=4+$\frac{1}{2}$(6-4×1-2)=4,所以采取sp3杂化,
故答案为:sp3杂化;
②过硫酸盐可以将Mn2+ 氧化成MnO4-,反应2Mn2++5S2O82-+8H2O$\frac{\underline{\;Ag+\;}}{\;}$2MnO4-+10SO42-+16H+中,该反应中,Mn元素的化合价升高(+2→+7),S元素的化合价降低(+7→+6),所以被还原的元素为S,
故答案为:硫;
③由反应可知,Mn元素的化合价升高(+2→+7),S元素的化合价降低(+7→+6),生成10molSO42-转移电子10mol电子,则每生成1 mol MnO4-,转移电子5mol电子,S2O8 2-断裂2.5mol(或2.5NA)O-O间非极性共价键,
故答案为:非极性键;2.5NA;
(3)①同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素,同主族从上到下,元素的第一电离能逐渐减小,所以N、O、S三种元素的第一电离能由大到小的顺序为:N>O>S,
故答案为:N>O>S;
②平均每46个水分子构成8个笼,晶体中每8个笼中有6个容纳了CH4分子,另外2个被2个游离的H2O分子所填充;所以天然气水合物的构成中含6个CH4分子、46+2=48个H2O分子,
则CH4分子与H2O分子粒子数比=6:48=1:8,可判断天然气水合物的平均组成可表示为CH4•8H2O,
故答案为:CH4•8H2O;
③由此结构可知,此单元中含有水分子的个数为:20,其中每个水分子形成的氢键属于2个五元环,故每个水分子形成氢键个数为:$\frac{3}{2}$,故总共形成氢键数为:20×$\frac{3}{2}$=30,
故答案为:30;
④冰中氢键的作用能为18.8kJ•mol-1,而冰熔化热为5.0kJ•mol-1,说明冰熔化为液态水时只是破坏了一部分氢键,并且液态水中仍在氢键,
故答案为:液态水中仍然存在大量氢键.
点评 本题考查核外电子排布、氧化还原反应、第一电离能、杂化、共价键类型等知识点,为高频考点,氧化还原反应须把握反应中元素的化合价变化,熟练应用杂化理论,掌握第一电离能变化规律为解答的关键,注意可燃冰的结构,题目难度中等.

| A. | 钠跟水反应 | |
| B. | Ba(OH)2•8H20晶体与NH4Cl晶体的反应 | |
| C. | 硫酸与氢氧化钡溶液反应 | |
| D. | 煤的燃烧 |
| A. | 在0.1 mol•L-1 NH4Cl溶液中:c(H+)=c(NH3•H2O)+c(OH-) | |
| B. | 10 mL 0.1 mol•L-1CH3COONa溶液与6 mL 0.2 mol•L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1 mol•L-1NH4HSO4溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 HCN溶液和0.05 mol•L-1 NaOH溶液等体积混合(pH>7):c(HCN)+c(H+)>c(OH-)+c(CN-) |
| A. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| B. | 不同元素的原子构成的分子中只含极性共价键 | |
| C. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| D. | 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下可自发进行,则该反应的△H>0 |
| A. | NO2或SO2都会导致酸雨的形成 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
| A. | 甲烷分子的比例模型是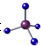 | B. | 二氧化碳的电子式: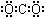 | ||
| C. | HClO的结构式为H-O-Cl | D. | 中子数为17的氯原子:${\;}_{17}^{37}$Cl |
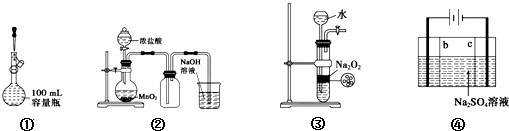
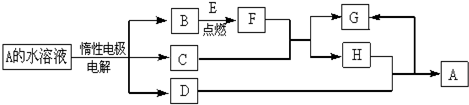
| A. | 装置①定容 | |
| B. | 装置②实验室制氯气 | |
| C. | 装置③用于制备少量氧气 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
| A. | 实验室制乙炔时用启普发生器得到的气体再用硫酸铜溶液除杂即可得到纯净的乙炔 | |
| B. | 实验室制得的乙炔气体直接通入酸性高锰酸钾溶液后,若紫色褪去则能证明乙炔中含有不饱和键可以被氧化剂氧化 | |
| C. | 芳香烃即可从石油的催化重整得到,也可从煤中直接分离得到 | |
| D. | 通过石油分馏得到的脂肪烃依然是混合物 |