题目内容
10.NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 0.2mol S在空气中充分燃烧,转移电子数为0.6NA | |
| C. | 0.1molCl2与足量的水充分反应,转移电子数为0.1NA | |
| D. | 1.5molNa2O2与足量的二氧化碳充分反应,转移电子数为1.5NA |
分析 A.亚铁离子和碘离子都能够被氯气氧化;
B.硫在空气中燃烧生成二氧化硫;
C.氯气与水反应为可逆反应;
D.1mol Na2O2与二氧化碳完全反应时转移电子数为1NA.
解答 解:A.1mol碘化亚铁完全反应消耗1.5mol氯气,转移电子数为3NA,故A错误;
B.0.2mol S在空气中充分燃烧,转移电子数为0.8NA,故B错误;
C.氯气与水反应为可逆反应,0.1molCl2与足量的水充分反应,转移电子数小于0.1NA,故C错误;
D.1mol Na2O2与二氧化碳完全反应时转移电子数为1NA,1.5molNa2O2与足量的二氧化碳充分反应,转移电子数为1.5NA,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意氧化还原反应转移电子数目的计算方法及可逆反应不能进行到底,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
1.下列实验操作正确的是( )
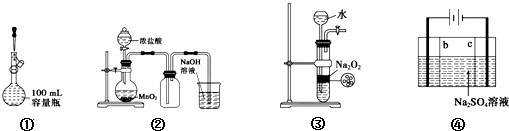

| A. | 装置①定容 | |
| B. | 装置②实验室制氯气 | |
| C. | 装置③用于制备少量氧气 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
18.已知0.1mol•L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
| A. | 在Na2A、NaHA两溶液中,离子种类相同 | |
| B. | 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等 | |
| C. | NaHA溶液pH一定大于7 | |
| D. | 在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-) |
5.吸收能量的反应一定是( )
| A. | 贮存能量 | B. | 释放能量 | ||
| C. | 生成物稳定性大于反应物的稳定性 | D. | 原子得到电子的反应 |
6.下列说法中正确的是( )
| A. | 实验室制乙炔时用启普发生器得到的气体再用硫酸铜溶液除杂即可得到纯净的乙炔 | |
| B. | 实验室制得的乙炔气体直接通入酸性高锰酸钾溶液后,若紫色褪去则能证明乙炔中含有不饱和键可以被氧化剂氧化 | |
| C. | 芳香烃即可从石油的催化重整得到,也可从煤中直接分离得到 | |
| D. | 通过石油分馏得到的脂肪烃依然是混合物 |
3.下列指定溶液中,一定能大量共存的离子组是( )
| A. | 常温下,由水电离出的氢离子浓度c(H+)=1×10-13mol/L的溶液中:Fe2+、NO3-、Ba2+、Cl- | |
| B. | 含有大量Al3+的溶液中:Na+、K+、NO3-、SiO32- | |
| C. | 无色透明溶液中:Mg2+、Fe3+、SO42-、SCN- | |
| D. | pH=13的溶液中:AlO2-、Na+、Cl-、CO32- |
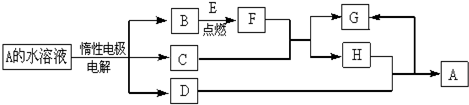
4.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D的单质中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F单质中燃烧,产物溶于水得到一种强酸.下列有关说法正确的是( )
| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | A与D元素所形成的化合物中只含极性键 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |