题目内容
15.下列微粒可以大量共存于同一溶液中的是( )| A. | NH4+、CH3COO-、Ca2+、Cl- | B. | Ca2+、Ag+、SO42-、NO3- | ||
| C. | Cu2+、H+、S2-、NO3- | D. | C6H5O-、Fe3+、H+、Cl- |
分析 根据离子或分子之间不能结合生成水、气体、沉淀等,不能发生氧化还原反应,则可大量共存,以此来解答.
解答 解:A.离子之间不发生反应,在溶液中可以大量共存,故A正确;
B.Ca2+、Ag+、SO42-反应生成沉淀,不能大量共存,故B错误;
C.H+、S2-、NO3-发生氧化还原反应,不能大量共存,故C错误;
D.C6H5O-、Fe3+、H+发生显色反应,不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存,为高考常见题型,侧重信息的抽取和复分解反应的考查,注重学生思维严密性的训练,有利于提高学生分析问题解决问题的能力,易错点为D,题目难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
1.下列实验操作正确的是( )
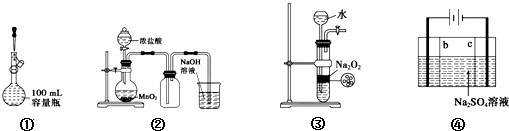

| A. | 装置①定容 | |
| B. | 装置②实验室制氯气 | |
| C. | 装置③用于制备少量氧气 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
6.下列说法中正确的是( )
| A. | 实验室制乙炔时用启普发生器得到的气体再用硫酸铜溶液除杂即可得到纯净的乙炔 | |
| B. | 实验室制得的乙炔气体直接通入酸性高锰酸钾溶液后,若紫色褪去则能证明乙炔中含有不饱和键可以被氧化剂氧化 | |
| C. | 芳香烃即可从石油的催化重整得到,也可从煤中直接分离得到 | |
| D. | 通过石油分馏得到的脂肪烃依然是混合物 |
3.下列指定溶液中,一定能大量共存的离子组是( )
| A. | 常温下,由水电离出的氢离子浓度c(H+)=1×10-13mol/L的溶液中:Fe2+、NO3-、Ba2+、Cl- | |
| B. | 含有大量Al3+的溶液中:Na+、K+、NO3-、SiO32- | |
| C. | 无色透明溶液中:Mg2+、Fe3+、SO42-、SCN- | |
| D. | pH=13的溶液中:AlO2-、Na+、Cl-、CO32- |
20.以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2.通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色.则下列说法中正确的是( )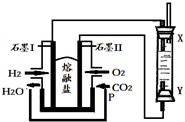

| A. | X、Y两端都必须用铁作电极 | |
| B. | 不可以用NaOH溶液作为电解液 | |
| C. | 阴极发生的反应是:2H2O+2e-=H2↑+2OH- | |
| D. | X端为电解池的阳极 |
7.在化学学习与研究中经常采用“推理”的思维方式,但有时也会得出错误的结论.下列“推理”正确的是( )
| A. | 较强酸可以制取较弱酸,推出H2S不能制取H2SO4 | |
| B. | 组成和结构相似的物质,沸点随相对分子质量增大而升高,推出SiH4沸点高于CH4 | |
| C. | 电解氯化铜溶液可得到Cu;则电解食盐水可以得到Na | |
| D. | 1mol O2和Mg完全反应获得4mol电子;则1mo1 O2和其他金属完全反应都获得4mol电子 |
4.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D的单质中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F单质中燃烧,产物溶于水得到一种强酸.下列有关说法正确的是( )
| A. | 工业上F单质用MnO2和AF来制备 | |
| B. | A与D元素所形成的化合物中只含极性键 | |
| C. | F所形成的氢化物的酸性强于BD2的水化物的酸性,说明F的非金属性强于B | |
| D. | 由化学键角度推断,能形成BDF2这种化合物 |
5.分子式为C8H10O的某芳香化合物有多种结构,其中含有-CH2OH基团的有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
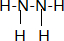 其中N的杂化轨道是sp3;联氨也有碱性,其碱性弱于氨 (填:强于、弱于);联氨的稳定性弱于氨(填:强于、弱于)
其中N的杂化轨道是sp3;联氨也有碱性,其碱性弱于氨 (填:强于、弱于);联氨的稳定性弱于氨(填:强于、弱于)