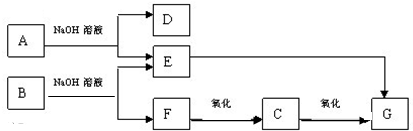
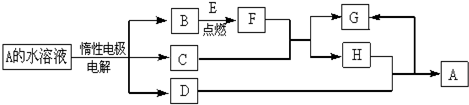
题目内容
11.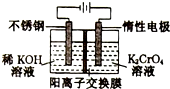 以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示意图如图,下列说法正确的是( )| A. | 在阳极室,通电后溶液逐渐由橙色变为黄色 | |
| B. | 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g | |
| C. | 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA | |
| D. | 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d |
分析 A、结合阳极室存在平衡2CrO42-+2H+?Cr2O72-+H2O来判断;
B、根据阴极反应:2H2O-4e-=O2↑+4H+和阳极反应:4H++4e-=2H2↑以及H+能由阳极移向阴极来分析;
C、结合电极方程式计算;
D、根据原子守恒计算其转化率.
解答 解:A.阳极室水失去电子,电极反应为:2H2O-4e-=4H++O2↑,使阳极区氢离子浓度增大,2CrO42-+2H+?Cr2O72-+H2O平衡右移,溶液逐渐由黄色变为橙色,故A错误;
B、由于阴极反应:2H2O-4e-=O2↑+4H+和阳极反应:4H++4e-=2H2↑,如果不考虑H+能由阳极移向阴极,则当有0.2mol电子通过时,阳极室质量减少0.2g,阴极室质量减少1.6g,此时阳极与阴极溶液减少的质量差为1.4g,但溶液中的H+能由阳极移向阴极移动,故阳极与阴极溶液减少的质量差小于1.4g,故B错误;
C、加入反应容器内的K2CrO4为0.4mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(0.4-x)mol,对应的n(K)=2(0.4-x)mol,n(Cr)=(0.4-x)mol,生成的K2Cr2O4为$\frac{x}{2}$mol,对应的n(K)=xmol,n(Cr)=xmol,根据K与Cr的物质的量之比为3:2,$\frac{2(0.4-x)+x}{0.4-x+x}$=$\frac{3}{2}$,计算得到x=0.2,4CrO42一+4H2O$\frac{\underline{\;电解\;}}{\;}$ 2Cr2O72一+4OH一+2H2↑+O2↑,反应可知反应4molCrO42一转移电子4mol,所以反应0.2molK2CrO4,电子转移0.2mol,故C错误;
D、设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为$\frac{x}{2}$mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,解得x=2-d,转化率为$\frac{2-d}{1}$=2-d,故D正确.
故选D.
点评 本题考查了电解原理,难点是计算转化率,根据原子守恒即可计算其转化率,根据阴阳极上发生的反应类型写出相应的电极反应式.

 名校课堂系列答案
名校课堂系列答案| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 纤维素、油脂是天然有机高分子化合物 | |
| C. | 白菜上洒少许福尔马林,既保鲜又消毒 | |
| D. | 棉、麻、合成纤维完全燃烧都只生成CO2和H2O |
| A. | 钠跟水反应 | |
| B. | Ba(OH)2•8H20晶体与NH4Cl晶体的反应 | |
| C. | 硫酸与氢氧化钡溶液反应 | |
| D. | 煤的燃烧 |
| A. | 往海带灰的浸泡液中加入过量的氯水,保证I-完全氧化为I2 | |
| B. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度 | |
| C. | 润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 | |
| D. | 实验室可以用浓硫酸与氯化钠固体共热制取氯化氢气体,因此浓硫酸与碘化钠固体共热也能制取碘化氢气体 |
| A. | 在0.1 mol•L-1 NH4Cl溶液中:c(H+)=c(NH3•H2O)+c(OH-) | |
| B. | 10 mL 0.1 mol•L-1CH3COONa溶液与6 mL 0.2 mol•L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 0.1 mol•L-1NH4HSO4溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=c(NH4+)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 HCN溶液和0.05 mol•L-1 NaOH溶液等体积混合(pH>7):c(HCN)+c(H+)>c(OH-)+c(CN-) |
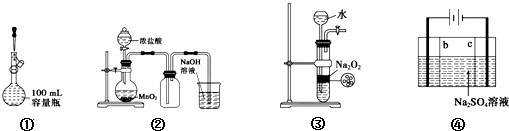
| A. | 装置①定容 | |
| B. | 装置②实验室制氯气 | |
| C. | 装置③用于制备少量氧气 | |
| D. | 利用装置④制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
 .
.