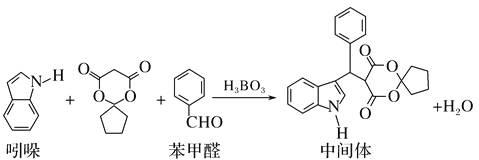
题目内容
【题目】根据反应KMnO4+FeSO4+H2SO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(未配平)设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。下列说法不正确的是( )
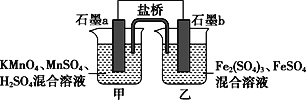
A. 石墨b是原电池的负极,发生氧化反应
B. 甲烧杯中的电极反应式:MnO4-+5e-+8H+===Mn2++4H2O
C. 电池工作时,盐桥中的阴阳离子分别向乙甲烧杯中移动,保持溶液中的电荷平衡
D. 忽略溶液体积变化,Fe2(SO4)3浓度变为1.5 mol/L,则反应中转移的电子为0.1 mol
【答案】D
【解析】A、根据所给反应方程式,Fe2+的化合价升高,依据原电池工作原理,因此石墨b为负极,发生氧化反应,故A说法正确;B、石墨a为正极,发生还原反应,电极反应式为MnO4-+5e-+8H+=Mn2++4H2O,故B说法正确;C、盐桥的作用是形成闭合回路,同时保持溶液中电荷平衡,根据原电池工作原理,阳离子向正极移动,即K+向甲烧杯移动,SO42-向乙烧杯移动,故C说法正确;D、生成Fe3+的物质的量为(200×10-3×1.5×2-200×10-3×1×2)mol=0.2mol,负极反应式为Fe2+=2e-=Fe3+,因此电路中转移电子物质的量0.2mol,故D说法错误。

【题目】科学家正在研究温室气体CH4和CO2的转化和利用。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用____________形象化描述。在基态14C原子中,核外存在___________对自旋相反的电子。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为__________________________。
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |

①下列关于CH4和CO2的说法正确的是________(填序号)。
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表所提供的数据分析,提出该设想的依据是______________________________________。
【题目】硫代硫酸钠(Na2S2O3·5H2O) 俗名“大苏打”。易溶于水,难溶于乙醇,沸点为100℃,酸性或加热条件下易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
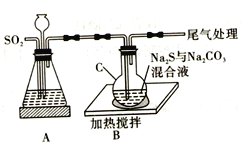
回答下列问题:
(1)装置A可用于观察SO2的生成速率,其中的液体最好选择_____________(填序号)。若装置堵塞使气流不畅,则A中的现象为_______________________________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
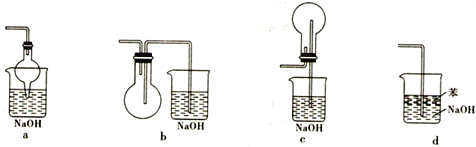
(2)尾气处理可以选择以下装置中的________(填序号)。
(3)反应过程中若pH值小于7则会降低产率,请用离子方程式解释原因:_________________________。
(4)请写出装置C中发生反应的化学方程式:_________________________。
(5)反应结束后,取C中混合物趁热过滤,取滤液于蒸发皿中, ______________,抽滤,洗涤,低温下干燥得产品。洗涤时要尽量减少产品的损失,其具体操作是_________________________。
(6)为检验制得的产品的纯度,该实验小组称取4g 的产品配制成250mL 硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入20mL 0.0lmol·L-1KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配的Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+ S4O62-,实验数据如下表:
实验序号 | 1 | 2 | 3 |
Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.2 |
当滴入最后一滴Na2S2O3溶液时,溶液___________,且半分钟内不变化,则达到终点。计算该产品的纯度是____________________________。