题目内容
【题目】化合物G是一种医药中间体,常用于制备抗凝血药.可以通过如图所示的路线合成:
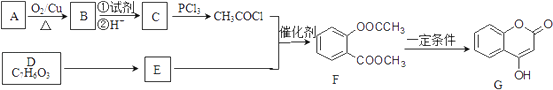
已知:RCOOH ![]() RCOCl;D与FeCl3溶液能发生显色.
RCOCl;D与FeCl3溶液能发生显色.
请回答下列问题:
(1)B→C的转化所加的试剂可能是__________ , C+E→F的反应类型是__________.
(2)有关G的下列说法正确的是_______ .
A.属于芳香烃
B.能与FeCl3溶液发生显色反应
C.可以发生水解、加成、氧化、酯化等反应
D.1mol G最多可以跟4mol H2反应
(3)E的结构简式为__________ .
(4)F与足量NaOH溶液充分反应的化学方程式为___________ .
(5)写出同时满足下列条件的E的同分异构体的结构简式__________ .
①能发生水解反应
②与FeCl3溶液能发生显色反应
③苯环上有两种不同化学环境的氢原子
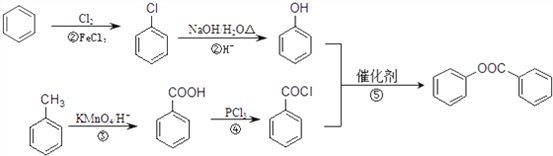
(6)已知:工业上以氯苯水解制取苯酚,而酚羟基一般不易直接与羧酸酯化.苯甲酸苯酚酯( ![]() )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用). 注:合成路线的书写格式参照如图示例流程图:__________
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用). 注:合成路线的书写格式参照如图示例流程图:__________
CH3CHO ![]() CH3COOH
CH3COOH ![]() CH3COOCH2CH3 .
CH3COOCH2CH3 .
【答案】 银氨溶液或新制氢氧化铜悬浊液 取代反应 CD ![]()
![]() +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ ![]() +H2O
+H2O 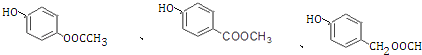
【解析】根据题中各物转化关系,结合信息RCOOH ![]() RCOCl,可以知道C为
RCOCl,可以知道C为![]() ,由A→B→C的转化条件可以知道,A被氧化成B,B再被氧化成C,所以B为
,由A→B→C的转化条件可以知道,A被氧化成B,B再被氧化成C,所以B为![]() ,A为
,A为![]() ,根据F的结构可以知道E发生取代反应生成F,所以E为
,根据F的结构可以知道E发生取代反应生成F,所以E为![]() ,D与
,D与![]() 溶液能发生显色,说明D中有酚羟基,根据D的分子式和E的结构可以知道,D与甲醇反应生成E,所以D的结构简式为
溶液能发生显色,说明D中有酚羟基,根据D的分子式和E的结构可以知道,D与甲醇反应生成E,所以D的结构简式为![]() ;
;
(1)B→C的转化是醛基氧化成羧基,所以所加的试剂可能是银氨溶液或新制氢氧化铜悬浊液;根据上面的分析可以知道,![]() →F的反应类型是取代反应;正确答案:银氨溶液或新制氢氧化铜悬浊液;取代反应。
→F的反应类型是取代反应;正确答案:银氨溶液或新制氢氧化铜悬浊液;取代反应。
(2)根据G的结构简式可以知道,G中有酯基、羟基、碳碳双键、苯环,G中有氧元素,所以不属于芳香烃,A错误;G中没有酚羟基,所以不能与![]() 溶液发生显色反应,B错误;G中有酯基、羟基、碳碳双键,可以发生水解、加成、氧化、酯化等反应,C正确;G中有苯环,一个苯环可以与三个
溶液发生显色反应,B错误;G中有酯基、羟基、碳碳双键,可以发生水解、加成、氧化、酯化等反应,C正确;G中有苯环,一个苯环可以与三个![]() 加成,一个碳碳双键可以与一个
加成,一个碳碳双键可以与一个![]() 加成,所以
加成,所以![]() G最多可以跟
G最多可以跟![]()
![]() 反应,D正确;正确选项CD。
反应,D正确;正确选项CD。
(3)根据上面的分析可以知道,E的结构简式为![]() ;正确答案:
;正确答案:![]() 。
。
(4)F中有两个酯基与足量NaOH溶液充分反应生成酚羟基也与氢氧化钠反应,所以反应的化学方程式为![]() +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ 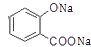 +H2O;正确答案:
+H2O;正确答案: ![]() +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ ![]() +H2O。
+H2O。
(5)E为![]() ,E的同分异构体中同时满足下列条件①能发生水解反应,说明有酯基,②与
,E的同分异构体中同时满足下列条件①能发生水解反应,说明有酯基,②与![]() 溶液能发生显色反应,有酚羟基,③苯环上有两种不同化学环境的氢原子,说明有两个基团处于苯环的对位,这样的结构简式有
溶液能发生显色反应,有酚羟基,③苯环上有两种不同化学环境的氢原子,说明有两个基团处于苯环的对位,这样的结构简式有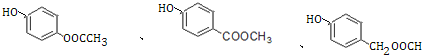 ;正确答案:
;正确答案: 。
。
(6)甲苯氧化生成苯甲酸,然后再三氯化磷的作用下发生取代生成![]() ;苯取代生成氯苯,水解生成苯酚;然后苯酚和
;苯取代生成氯苯,水解生成苯酚;然后苯酚和![]() 发生取代生成
发生取代生成![]() ;合成流程图为:
;合成流程图为: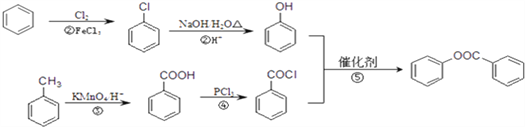 ;正确答案:
;正确答案: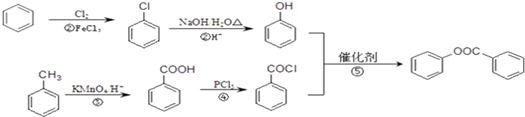 。
。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
③CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) ΔH3=+23.5 kJ/mol
2CH3OH(g) ΔH3=+23.5 kJ/mol
则反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g)的△H=________.
CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO: 与NO2 反应生成SO,和NO,将混合气体经冷凝分离出的SO,可用于制备硫酸。
①973 K时,测得:
NO2(g)![]() NO(g)+ 1/2O2(g) K1=0.018;
NO(g)+ 1/2O2(g) K1=0.018;
SO2(g)+1/2O2(g)![]() SO3(g) K2=20;
SO3(g) K2=20;
则反应SO2(g)+NO2(g)![]() SO3(g)+NO(g)的K3=________
SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充人SO2、NO2 各0.2mol。平衡时SO2的转化率为________。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
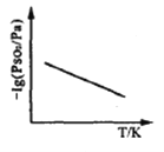
当温度升高时,SO2(g)+NO2(g)![]() SO3(g)+NO(g)的化学平衡常数_____(填“增大”或“减小”), 判断理由 是_________.
SO3(g)+NO(g)的化学平衡常数_____(填“增大”或“减小”), 判断理由 是_________.
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若PH偏低将会导致NO3-的去除率下降,其原因是___________.
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。
下表中Ⅰ和Ⅱ产生差异的原因可能是____;Ⅱ中0~20min,用NO3-表示的平均反应速率为____mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol/L | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol/L (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.[Na+]+[H+]=[HSO3-]+2[SO32-]+[OH-]
B.[Na+]=[HSO3-]+[SO32-]+[H2SO3]
C.[Na+]>[SO32-]>[HSO3-]>[OH-]>[H+]
D.[H+]+[SO32-]=[OH-]+[H2SO3]