题目内容
20.浩瀚的海洋是一个巨大的宝库,海水就是一项等待开发的资源.海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3- 等离子.合理利用水资源是持续发展的重要保证.Ⅰ:火力发电是广东的重要能源,但是烧煤排放的SO2会造成一系列环境问题.利用海水脱硫是一种有效地方法.其工艺流程如下图所示:

(1天然海水pH≈7.9,呈弱碱性.用离子方程式解释其原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(写一个).
(2)天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应原理的化学反应方程式是2H2SO3+O2=2H2SO4;氧化后的海水需要加入氢氧化钠,与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
Ⅱ:微量的重金属污染,可以通过生物链作用而产生富集.当人因为饮用或食用受重金属污染的水和食物,体内重金属含量过高时,便会导致各种疾病.某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子.有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)某工程师用CaO处理上述废水,最终溶液的pH=8,请你计算处理后废水中Pb2+的浓度为1.2×10-9mol•L-1.
分析 I、(1)海水中的弱酸根离子水解显碱性;
(2)H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+);
Ⅱ、(3)溶度积越小越易转化为沉淀,根据表格中的数据进行判断最近试剂;
(4)先计算出溶液中氢氧根离子的物质的量浓度,然后根据Pb(OH)2的溶度积及c(Pb2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$进行计算.
解答 解:I、(1)天然海水的pH≈8,是因为海水中有CO32-或HCO3-+它们水解使海水呈弱碱性,其离子方程式为CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-;
(2)H2SO3中的S显+4价,均可被O2氧化生成H2SO4,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),
故答案为:2H2SO3+O2=2H2SO4;中和、稀释经氧气氧化后海水中生成的酸(H+);
Ⅱ、(3)溶度积越小的越易转化为沉淀,由表格中的数据可知,硫化物的溶度积小,则应选择硫化钠,
故答案为:B;
(4)由Pb(OH)2的溶度积为1.2×10-15,pH=11.0,c(OH-)=10-3mol•L-1,则c(Pb2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=$\frac{1.2×1{0}^{-15}}{(1{0}^{-3})^{2}}$=1.2×10-9mol•L-1,
故答案为:1.2×10-9mol•L-1 .
点评 本题考查了含硫烟气的处理及难溶物的沉淀转化,利用所学知识结合框图信息是解答本题的关键,难度中等,注意把握Ksp的有关计算的方法.

 寒假学与练系列答案
寒假学与练系列答案| A. | 压强为原来的两倍 | B. | 平衡向右移动,混合气体颜色变浅 | ||
| C. | 压强增大,但小于原来的两倍 | D. | 平衡向右移动,混合气体密度增大 |
| A. | 金属钠高温还原CO2,制人工金刚石膜或粉 | |
| B. | 汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠 | |
| C. | 隔绝空气条件下加热金属钠与NaNO2反应制取Na2O | |
| D. | 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热 |
| A. | 若升高温度,X(g)的浓度增大,则正反应为吸热反应 | |
| B. | 若容器体积不变,在平衡混合物中加入少量Z(s),则平衡向左移动 | |
| C. | 压强变化对该平衡没有影响 | |
| D. | 若容器体积不变,加入氦气平衡不移动 |
| A. | 乙烯 | B. | 丙烯醛 | C. | 乙醇 | D. | 丁烷 |
| A. | 聚乙烯可发生加成反应 | |
| B. | 乙烯和甲烷可用酸性高锰酸钾溶液鉴别 | |
| C. | 乙烯和苯都能与溴水反应 | |
| D. | 乙烯和乙烷都能发生加成反应 |
| A. | 乙烯的实验式:C2H4 | B. | 乙炔的电子式: | ||
| C. | 甲酸甲酯的结构简式:C2H4O | D. | 氢氧根电子式: |
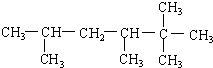 2,2,3,5-四甲基己烷
2,2,3,5-四甲基己烷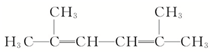 2,5-二甲基-2,4-己二烯.
2,5-二甲基-2,4-己二烯.

 ;
; 、
、 .
.