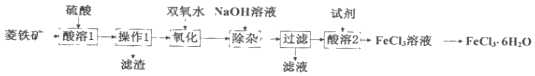
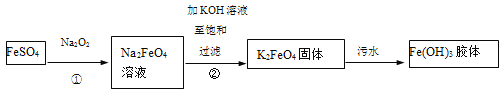
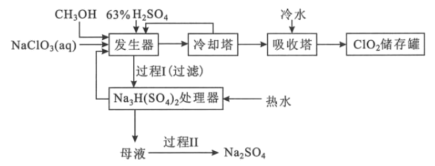
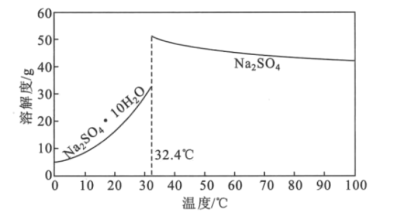
题目内容
【题目】工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g)。
(1)在—定温度和压强下,CO(g)+2H2(g)![]() CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
CH3OH(g) ΔH=-128.8 kJ/mol。若将10a mol CO和20a mol H2放入2 L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为________(用含a的代数式表示)。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是________(填“正向移动”、“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度________(填“增大”、“不变”或“减小”)。
(2)判断该反应达到平衡状态的依据是________(填字母序号)。
a.混合气体的密度不变 b.混合气体的平均相对分子质量不变 c.2v逆(H2)=v正(CO) d.容器内CO、H2、CH3OH的浓度之比为1∶2∶1 e.CH3OH、CO、H2的浓度都不再发生变化
【答案】![]() 正向移动 增大 be
正向移动 增大 be
【解析】
(1)起始时CO为10a mol,转化率为60%,所以反应的CO为6a mol,用三段式求平衡常数:
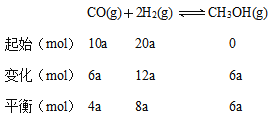
容器体积为2L,所以平衡时CO、H2、CH3OH的浓度分别为2a mol/L、4a mol/L、3a mol/L,则则该反应的平衡常数为![]() L2/mol2。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),CO、H2、CH3OH的物质的量分别为14a mol、28a mol、16a mol,浓度为7a mol/L、14a mol/L、8a mol/L,计算此时的
L2/mol2。若此时再向该容器中投入10a mol CO、20a mol H2和10a mol CH3OH(g),CO、H2、CH3OH的物质的量分别为14a mol、28a mol、16a mol,浓度为7a mol/L、14a mol/L、8a mol/L,计算此时的![]() <
<![]() ,所以平衡正向移动;由于加入了CO,而容器体积不变,所以与原平衡相比,CO的物质的量浓度增大了;故答案为:
,所以平衡正向移动;由于加入了CO,而容器体积不变,所以与原平衡相比,CO的物质的量浓度增大了;故答案为:![]() ,正向移动,增大;
,正向移动,增大;
(2)a.混合气体的密度等于混合气的总质量除以容器的体积,由于反应物和生成物都是气体,根据质量守恒,混合气的总质量是不变的,容器体积一定,所以混合气的密度一直不变,所以密度不变不能说明该反应达到平衡状态;
b.混合气体的平均相对分子质量等于总质量除以总物质的量,总质量是不变的,但总物质的量在未平衡前是减小的,故当混合气体的平均相对分子质量不再变化时,反应达到了平衡状态;
c.用H2和CO表示的正逆反应速率之比等于化学方程式的化学计量数之比时,可以说明反应达到平衡状态,应为v逆(H2)=2v正(CO);
d.容器内CO、H2、CH3OH的浓度之比等于方程式的化学计量数之比和是否平衡无关,故容器内CO、H2、CH3OH的浓度之比为1∶2∶1不能说明反应达到平衡;
e.各物质的浓度不再变化可以说明反应达到平衡状态,故当CH3OH、CO、H2的浓度都不再发生变化可以说明反应达到了平衡状态;
故选be。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】(1)已知常温时,0.1 mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=__,醋酸的电离平衡常数K=__。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
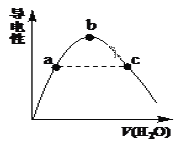
① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-) __c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8 | Ka1=4.3 | Ka=3.0 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________。