题目内容
【题目】下列化学反应中,不是氧化还原反应的是( )
A.3NO2 + H2O = 2HNO3 + NOB.2 H2+O2![]() 2H2O
2H2O
C.Cl2+H2O=HClO+HClD.CuCl2+Ba(OH)2=Cu(OH)2+BaCl2
【答案】D
【解析】
氧化还原反应的特征是有化合价的变化,有化合价变化的化学反应属于氧化还原反应。
A. 该反应中N的化合价从+4升高到+5,价,从+4降到+2,有化合价的变化,属于氧化还原反应,故A不符合题意;
B. 该反应中氢元素化合价由0价变为+1价、氧元素化合价由0价变为-2价,所以属于有单质参加的化合反应,属于氧化还原反应,故B不符合题意;
C. 该反应中氯元素化合价从0价升到+1价,从0价降到-1价,属于氧化还原反应,故C不符合题意;
D. 该反应中没有元素发生化合价的变化属于复分解反应,不属于氧化还原反应,故D符合题意;
答案选D。

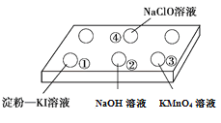
【题目】把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验 | 现象 |
| ①中溶液变蓝且无其他明显现象 |
②中无明显现象 | |
③中溶液褪色 | |
④中产生黄绿色气体 |
下列分析正确的是( )
A.①中现象体现了浓盐酸的氧化性
B.②中现象说明未发生反应
C.③中反应后氯元素全部以KCl形式存在
D.④中产生黄绿色气体的反应是:ClO-+ Cl-+ 2H+ = Cl2↑+ H2O
【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 |
|
|
|
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 |
|
|
|
回答下列问题:
(1)pH相等的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液中,物质的量浓度最小的是____________(填化学式)。
溶液中,物质的量浓度最小的是____________(填化学式)。
(2)已知![]() 为正盐,依据表格数据,
为正盐,依据表格数据,![]() 的第二级电离平衡常数表达式
的第二级电离平衡常数表达式![]() ___________;25℃时,5.6mol·L-1
___________;25℃时,5.6mol·L-1![]() 溶液的pH=____________。
溶液的pH=____________。
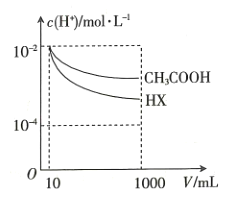
(3)向体积均为10mL、![]() 均为
均为![]() mol·L-1的
mol·L-1的![]() 溶液和一元酸
溶液和一元酸![]() 溶液中,分别加水稀释至1000mL,稀释过程中
溶液中,分别加水稀释至1000mL,稀释过程中![]() 的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)
的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)![]() 的电离平衡常数,理由是______________________________。
的电离平衡常数,理由是______________________________。
(4)常温下,将0.05mol·L-1的氨水逐滴加入10mL0.1mol·L-1![]() 溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。