题目内容
【题目】以菱铁矿(主要成分为FeCO3,还含有少量Al2O3、SiO2等杂质)为原料,在实验室中制备FeCl36H2O晶体的流程如图所示,下列说法不正确的是( )
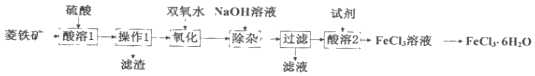
A.“操作1”需要用到的玻璃仪器有烧杯、玻璃棒、漏斗
B.“除杂”时,为了分离Fe3+和Al3+,应加入过量的NaOH溶液
C.“酸溶1”与“酸溶2”所加的试剂相同
D.在坩埚中对FeCl3溶液进行蒸发结晶可得FeCl36H2O晶体
【答案】CD
【解析】
以菱铁矿(主要成分为FeCO3,含有Al2O3、SiO2)为原料,加入稀硫酸酸溶过滤得到滤液为硫酸铝、硫酸亚铁溶液,滤渣为SiO2,滤液中加入过氧化氢氧化亚铁离子为铁离子,加入过量氢氧化钠溶液沉淀铁离子,过滤得到氢氧化铁,滤液为偏铝酸钠和氢氧化钠的混合溶液,向过滤后所得固体,用水洗涤固体2﹣3次,加入稀盐酸使固体完全溶解,在氯化氢氛围内蒸发浓缩、冷却结晶,过滤,低温干燥,得到FeCl36H2O,以此解答该题。
A、操作1为过滤,用到的玻璃仪器有烧杯、玻璃棒、漏斗,故A正确;
B、加入过量氢氧化钠,可生成氢氧化铁、偏铝酸钠,以达到分离的目的,故B正确;
C、酸溶1加入硫酸,酸溶2加入盐酸,试剂不同,故C错误;
D、氯化铁易水解,一般在氯化氢氛围内蒸发浓缩、冷却结晶,过滤,低温干燥,得到FeCl36H2O,故D错误;
答案选CD。

练习册系列答案
相关题目