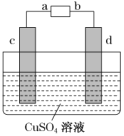
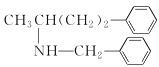题目内容
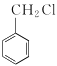
【题目】化合物![]() (如图)是一种重要的材料中间体,下列有关化合物
(如图)是一种重要的材料中间体,下列有关化合物![]() 的说法中正确的是
的说法中正确的是
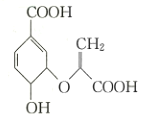
A.分子中含有三种官能团
B.可与乙醇、乙酸反应
C.所有碳原子一定处于同一平面
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
【答案】B
【解析】
A.该有机物中含有碳碳双键、醚键、羟基、羧基4种官能团,故A错误;
B.含有羟基可以和乙酸发生酯化,含有羧基可以和乙醇酯化,故B正确;
C.双键上的碳原子和与该碳原子之间相连的碳原子处于同一平面,该物质含有多个双键结构,也即有多个平面结构,各平面之间由单键相连,单键可以旋转,所以所有碳原子不一定处于同一平面,故C错误;
D.含有双键可以与溴发生加成反应使溴水褪色,双键、羟基可以被酸性高锰酸钾氧化从而使其褪色,原理不同,故D错误;
故答案为B。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】(1)25 ℃时,将体积Va、pH=a的某一元强碱与体积为Vb、pH=b的某二元强酸混合。
①若所得溶液的pH=11,且a=13,b=2,则Va∶Vb=____________。
②为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg![]() 。25 ℃时,若溶液呈中性,则AG=___,溶液的pH与AG的换算公式为AG=_____。
。25 ℃时,若溶液呈中性,则AG=___,溶液的pH与AG的换算公式为AG=_____。
(2)常温下,浓度均为0.1molL-1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合H+能力最强的是____。
②根据表中数据,浓度均为0.01 molL-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是__(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3)已知常温下,Ksp[Fe(OH)3]=4.0×10-38,在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:_______;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为__mol/L。