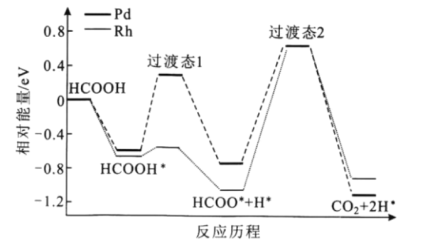
题目内容
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。工业上制备高铁酸钾以及高铁酸钾处理污水的部分流程如下:
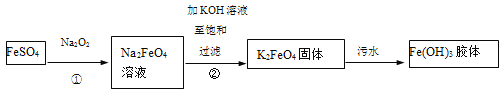
以下说法不正确的是
A.①中一定发生了氧化还原反应
B.污水处理中产生Fe(OH)3胶体,使悬浮物聚沉,利用了胶体具有较强吸附能力的特点
C.另一种在碱性条件下制备K2FeO4的反应可能是:2Fe(OH)3+3ClO-=2FeO42-+3Cl-+4H+ +H2O
D.K2FeO4还可以用于处理废水,例如可以把废水中的CN-转化为两种无毒气体,反应过程中,CN-做还原剂,被K2FeO4氧化
【答案】C
【解析】
硫酸亚铁溶液中加入过氧化钠发生氧化还原反应生成高铁酸钠溶液,向反应生成的高铁酸钠溶液加入足量氢氧化钾溶液至饱和,由于相同温度下,高铁酸钾的溶解度小于高铁酸钠,故转化为高铁酸钾沉淀,高铁酸钾在水中发生如下过程:4FeO42-+10H2O4Fe(OH)3(胶体)+8OH-+3O2↑,反应中高铁酸钾做氧化剂,具有杀菌消毒作用,生成的Fe(OH)3胶体具有吸附作用,可吸附水中的固体杂质,使悬浮物聚沉,从而起到杀菌消毒和吸附净化水的作用。
A.硫酸亚铁中加入过氧化钠反应后的产物为高铁酸钠,硫酸亚铁中铁为+2价,高铁酸钠中铁为+6价,铁元素化合价发生变化,则①中一定发生了氧化还原反应,故A正确;
B. 高铁酸钾在水中发生如下过程:4FeO42-+10H2O4Fe(OH)3(胶体)+8OH-+3O2↑,生成的Fe(OH)3胶体具有吸附作用,可吸附水中的固体杂质,使悬浮物聚沉,故B正确;
C. 氢离子与氢氧根离子不能共存,在碱性条件下制备K2FeO4的反应产物中不可能产生氢离子,正确的反应为:2Fe(OH)3+3ClO+4OH=2FeO42+3Cl+5H2O,故C错误;
D. K2FeO4还可以用于处理废水,可将可以把废水中的CN-转化为两种无毒气体,该两种无毒气体为二氧化碳和氮气,根据转化关系,氮元素和碳元素化合价都升高,故反应过程中,CN-做还原剂,高铁酸钾做氧化剂,故D正确;
答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 |
|
|
|
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 |
|
|
|
回答下列问题:
(1)pH相等的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液中,物质的量浓度最小的是____________(填化学式)。
溶液中,物质的量浓度最小的是____________(填化学式)。
(2)已知![]() 为正盐,依据表格数据,
为正盐,依据表格数据,![]() 的第二级电离平衡常数表达式
的第二级电离平衡常数表达式![]() ___________;25℃时,5.6mol·L-1
___________;25℃时,5.6mol·L-1![]() 溶液的pH=____________。
溶液的pH=____________。
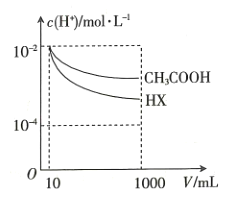
(3)向体积均为10mL、![]() 均为
均为![]() mol·L-1的
mol·L-1的![]() 溶液和一元酸
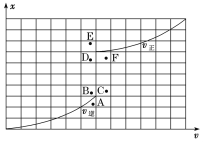
溶液和一元酸![]() 溶液中,分别加水稀释至1000mL,稀释过程中
溶液中,分别加水稀释至1000mL,稀释过程中![]() 的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)
的变化如图所示,则HX的电离平衡常数____________(填“大于”“小于”或“等于”)![]() 的电离平衡常数,理由是______________________________。
的电离平衡常数,理由是______________________________。
(4)常温下,将0.05mol·L-1的氨水逐滴加入10mL0.1mol·L-1![]() 溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。
溶液中至溶液显中性,此时溶液中各离子浓度大小关系为_________________。