题目内容
9.如表列出了A~R 9种元素在周期表中的位置:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素氢化物的化学式是H2O,该氢化物含有的化学键是共价键,该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;该氢化物的沸点比同主族其它元素的氢化物的沸点高(填“高”或“低”),原因是水中存在氢键.
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程
 .
.(6)G元素和H元素两者核电荷数之差是18.G和H的最高价氧化物对应的水化物的酸性较弱的是(写化学式)HBrO4.
分析 (1)根据元素周期表中元素活泼性的递变规律来回答;
(2)氢氧化铝是两性氢氧化物,能和强碱反应生成盐和水;
(3)电子层越多半径越大,电子层相同的同周期元素的原子从左到右半径逐渐减小;
(4)水是由H和O两种元素形成的共价化合物,含有共价键,K与水反应生成氢氧化钾和氢气,水中存在氢键,故熔沸点较高;
(5)溴化钠中含有钠元素,焰色反应为黄色,其为离子化合物,据此利用电子式表示其形成过程;
(6)同主族元素原子序数之差等与上一周期元素的种数,元素的非金属性越强,其对应最高价氧化物的水化物的酸性越强.
解答 解:根据元素在周期表中的分布知识,可以知道A是Na,B是K,C是Mg,D是Al,E是C,F是O,G是Cl,H是Br,R是Ar.
(1)A是Na,B是K,C是Mg,D是Al,E是C,F是O,G是Cl,H是Br,R是Ar,元素周期表中元素活泼性最差的是稀有气体元素的单质,即Ar最不活泼,故答案为:Na、K、Mg、Al、C、O、Cl、Br、Ar;Ar;
(2)铝元素最高价氧化物对应的水化物氢氧化铝是两性氢氧化物,能与氢氧化钠反应,离子方程式是Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)电子层越多半径越大,所以K的半径最大,电子层相同的同周期元素的原子从左到右半径逐渐减小,所以Na>Mg,故答案为:K>Na>Mg;
(4)O元素氢化物的化学式是H2O,含有共价键,K与水反应生成氢氧化钾和氢气,化学反应方程式为:2K+2H2O=2KOH+H2↑,由于水中存在氢键,故水的沸点比同主族其它元素的氢化物的沸点,故答案为:H2O;共价键;2K+2H2O=2KOH+H2↑;高;水中存在氢键;
(5)Na与Br形成NaBr,NaBr属于离子化合物,Na原子最外层电子被Br原子得到,其化合物形成过程为: ,
,
故答案为:NaBr;黄; ;
;
(6)Cl元素和Br元素两者核电荷数之差是第三周期元素的种数,即为18,由于非金属性Cl>Br,故酸性较弱的是:HBrO4,
故答案为:18;HBrO4.
点评 本题考查元素周期表与元素周期律的综合应用,涉及电子式的书写、化学反应方程式书写、氢键等,比较基础,注意整体把握元素周期表结构,注意基础知识的积累掌握.

| A. | 钾 | B. | 钠 | C. | 镁 | D. | 铝 |
| A. | 0.05mol/(L•s) | B. | 0.05mol/L | C. | 0.20 mol/(L•s) | D. | 0.20mol/L |
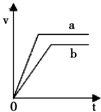 取两份10mL 1mol•L-1稀盐酸,向其中一份中加入过量的锌粒,得到气体的体积随时间变化如b所示,向另一份中加入过量的锌粒同时加入另一种物质,得到气体的体积如a所示,则另一种物质是( )
取两份10mL 1mol•L-1稀盐酸,向其中一份中加入过量的锌粒,得到气体的体积随时间变化如b所示,向另一份中加入过量的锌粒同时加入另一种物质,得到气体的体积如a所示,则另一种物质是( )| A. | 铝粉 | B. | 3 mol•L-1稀硫酸 | C. | 铁粉 | D. | 氢氧化钠固体 |
 铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:
铁、铜及其化合物在日常生产、生活有着广泛的应用.请回答下列问题:



 ,若该烷烃可由3种单烯烃与H2加成得到,则该烯烃可能的结构简式是CH2=C(CH3)CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2.
,若该烷烃可由3种单烯烃与H2加成得到,则该烯烃可能的结构简式是CH2=C(CH3)CH2CH3、(CH3)2C=CHCH3、(CH3)2CHCH=CH2.