题目内容
18.图中的数字代表的是原子序数,图中数字所表示的元素与它们在元素周期表中的实际位置相符的是( )| A. |  | B. |  | C. |  | D. |  |
分析 根据元素周期表的结构可知,相邻两个周期同主族元素的原子序数相差2、8、18、32,以此判断同族中位置关系.同周期元素根据原子序数判断位置关系,注意第三列镧系、锕系,长周期第ⅡA族、第ⅢA族之间有10个空列为7个副族和1个Ⅷ族,以此来解答.
解答 解:A.7、8、9为第二周期相邻的N、O、F元素,8、16、34为第ⅥA族相邻的元素O、S、Se,符合位置关系,故A正确;
B.4为Be、5为B,中间有10个空列为7个副族和1个Ⅷ族,故B错误;
C.1为H,2为He,分别为第1列与第18列,且H与Na(原子序数为11)不相邻,不符合位置关系,故C错误;
D.10 为Ne,位于第18列,而17为Cl,35为Br,Cl、Br同主族,不符合位置关系,故D错误;
故选A.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、原子序数等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8. 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )
 短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )
短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为20.则下列说法不正确的是( )| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 原子半径大小:Y<X<W | |
| C. | 氢化物的稳定性X<Y | |
| D. | X和Y形成的化合物升华破坏的是共价键 |
9.如表列出了A~R 9种元素在周期表中的位置:
(1)这9种元素分别为(写元素符号)ANa、BK、CMg、DAl、EC、FO、GCl、HBr、RAr,其中化学性质最不活泼的是Ar;
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素氢化物的化学式是H2O,该氢化物含有的化学键是共价键,该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;该氢化物的沸点比同主族其它元素的氢化物的沸点高(填“高”或“低”),原因是水中存在氢键.
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程 .
.
(6)G元素和H元素两者核电荷数之差是18.G和H的最高价氧化物对应的水化物的酸性较弱的是(写化学式)HBrO4.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
(2)D元素的最高价氧化物对应的水化物与A元素的最高价氧化物对应的水化物反应的离子方程式是Al(OH)3+OH-=AlO2-+2H2O;
(3)A、B、C三种元素按原子半径由大到小的顺序排列为(写元素符号)K>Na>Mg;
(4)F元素氢化物的化学式是H2O,该氢化物含有的化学键是共价键,该氢化物在常温下跟B元素的单质发生反应的化学方程式是2K+2H2O=2KOH+H2↑;该氢化物的沸点比同主族其它元素的氢化物的沸点高(填“高”或“低”),原因是水中存在氢键.
(5)H元素跟A元素形成化合物的化学式是NaBr,高温灼烧该化合物时,火焰呈黄色;用电子式表示该化合物的形成过程
 .
.(6)G元素和H元素两者核电荷数之差是18.G和H的最高价氧化物对应的水化物的酸性较弱的是(写化学式)HBrO4.
6.用铂(惰性)电极进行电解,下列说法中正确的是( )
| A. | 电解氯化钠溶液,在阴极析出钠 | |
| B. | 电解熔融氯化镁制取镁时,阴极和阳极生成的产物物质的量之比为1:1 | |
| C. | 电解稀硫酸,在阴极和阳极分别产生氧气和氢气 | |
| D. | 电解熔融氧化铝过程中,若有3.01×1024个电子转移,则生成1mol铝 |
3.下列反应的离子方程式正确的是( )
| A. | 硫酸与氢氧化钡在溶液中反应:Ba2++SO42-═BaSO4↓ | |
| B. | 在NaOH溶液中加入醋酸溶液:H++OH-═H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 向FeI2溶液中通入过量Cl2:2Fe2++Cl2═2Fe3++2Cl- |

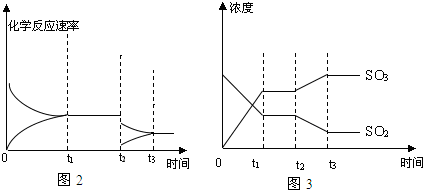
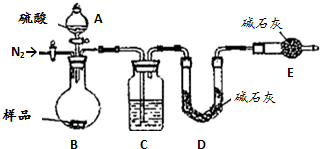

 有止血作用,特别对内脏的止血效果较好.
有止血作用,特别对内脏的止血效果较好. .
. .
.