题目内容
9.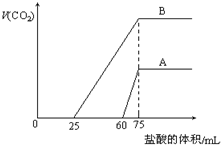 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )| A. | A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 Na2CO3和NaHCO3 | |
| B. | B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3- | |
| C. | B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL | |
| D. | 原NaOH溶液的物质的量浓度为1.0mol/L |
分析 A、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质.
B、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,根据消耗盐酸体积相对大小确定所得溶液中的溶质,从而确定发生的离子反应.
C、先确定B溶液中的溶质,再根据碳酸氢钠和盐酸的反应方程式计算生成二氧化碳的体积.
D、先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,根据盐酸的物质的量计算氢氧化钠的物质的量浓度.
解答 解:A、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于A溶液来说,滴加盐酸60mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积远远大于碳酸氢钠生成氯化钠需要盐酸的体积,说明原溶液中的溶质是氢氧化钠和碳酸钠,故A错误.
B、当生成CO2气体时,发生反应HCO3-+H+=H2O+CO2↑,对于B溶液来说,滴加盐酸25mL时没有气体生成,可能发生OH-+H+=H2O和CO32-+H+=HCO3-,假设原溶液中只有碳酸钠,生成碳酸氢钠需要盐酸的体积和碳酸氢钠生成氯化钠需要盐酸的体积相等,实际上需要盐酸的体积小于碳酸氢钠生成氯化钠需要盐酸的体积,说明原溶液中的溶质是碳酸钠和碳酸氢钠,所以B线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:H++CO32-=HCO3-,故B错误.
C、通过C知,B溶液中的溶质是碳酸钠和碳酸氢钠,碳酸钠和盐酸反应生成碳酸氢钠,有气体生成的化学反应方程式为:HCO3-+H+=H2O+CO2↑,所以当盐酸的为25mL时有二氧化碳生成,即发生的化学反应为:HCO3-+H+=H2O+CO2↑,设生成气体的体积为V.
HCO3-+H+=H2O+CO2↑
1mol 22.4L
0.2(0.075-0.025)mol V
V=$\frac{22.4L×0.2(0.075-0.025)mol}{1mol}$=0.224L=224mL,故C正确.
D、先向氢氧化钠溶液中通入二氧化碳,后向通入二氧化碳的氢氧化钠溶液中滴加盐酸,当二氧化碳气体完全放出时,溶液的溶质是氯化钠,该反应的实质是盐酸和氢氧化钠反应生成氯化钠,盐酸和氢氧化钠反应的物质的量之比为1:1,设氢氧化钠的物质的量浓度为Cmol/L,0.01L×Cmol/L=0.2mol/L×0.075L,C=1.5mol/L,故D错误.
故选C.
点评 本题考查混合物的计算,题目难度较大,本题关键是根据图象判断溶液溶质的成分,结合离子方程式利用守恒定律计算.

| A. | 蒸发皿 | B. | 烧瓶 | C. | 漏斗 | D. | 分液漏斗 |
| A. | 白锡比灰锡稳定 | |
| B. | 在常温下锡以灰锡状态存在 | |
| C. | 灰锡转化为白锡的反应是放热反应 | |
| D. | 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 |
| A. | 该反应一定是放热反应 | |
| B. | 该反应一定是吸热反应 | |
| C. | 该反应反应物的总能量一定大于产物的总能量 | |
| D. | 该反应产物的总能量一定大于反应物的总能量 |
①镁易与热水反应,而铝难与热水反应
②镁溶于碱溶液,而铝难溶于碱溶液
③常温下镁难溶于浓硫酸,而铝易溶于浓硫酸
④镁和铝都可制轻合金,用作制船舶、飞机等的材料
⑤镁铝都可作还原剂,与某些氧化物反应.
| A. | ①② | B. | ①③ | C. | ①④⑤ | D. | 全部 |
| A. | 有3 molCl2被还原 | B. | 氧化产物为1mol | ||
| C. | 氧化产物为8mol | D. | 生成N2 4mol |
| A. | 单位时间生成n摩尔A,同时生成3n摩尔B | |
| B. | A,B,C的浓度不再变化 | |
| C. | A,B,C的分子数之比为1:3:2 | |
| D. | V正=V逆=0 |