题目内容
4.已知某反应的焓变小于零,则下列叙述正确的是( )| A. | 该反应一定是放热反应 | |
| B. | 该反应一定是吸热反应 | |
| C. | 该反应反应物的总能量一定大于产物的总能量 | |
| D. | 该反应产物的总能量一定大于反应物的总能量 |
分析 △H=生成物总能量-反应物总能量,某反应的焓变小于零,说明正反应放热,反应物总能量高于生成物,据此分析.
解答 解:△H=生成物总能量-反应物总能量,某反应的焓变小于零,说明正反应放热,反应物总能量高于生成物,
A.该反应一定是放热反应,故A正确;
B.该反应一定是放热反应,故B错误;
C.反应物总能量高于生成物,故C正确;
D.反应物总能量高于生成物,故D错误;
故选AC.
点评 本题考查了放热反应反应物总能量高于生成物的判断,题目难度不大,注意把握△H=生成物总能量-反应物总能量.

练习册系列答案
相关题目
15.下列离子方程式中,正确的是( )
| A. | FeSO4溶液与H2O2溶液混合:Fe2++2H2O2+4H+=Fe3++4 H2O | |
| B. | 小苏打溶液与稀硫酸混合:CO32-+2 H+=CO2↑+H2O | |
| C. | 大理石溶解于醋酸:CaCO3+2 H+=Ca2++CO2↑+H2O | |
| D. | 明矾溶液水解:Al3++3 H2O?Al(OH)3+3H+ | |
| E. | 氢氧化铁与氢碘酸反应:Fe(OH)3+3 H+=Fe3++3H2O |
12.物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
| A. | NH4NO3 | B. | NH4HSO4 | C. | CH3COONH4 | D. | NH4HCO3 |
19.对于3Fe(s)+4H2O(g)$\stackrel{高温}{?}$Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为( )
| A. | K=$\frac{[Fe_3O_4]•[H_2]}{[Fe]•[H_2O]}$ | B. | K=$\frac{[Fe_3O_4]•[H_2]^4}{[Fe]•[H_2O]^4}$ | ||
| C. | K=$\frac{[H_2O]^4}{[H_2]^4}$ | D. | K=$\frac{[H_2]^4}{[H_2O]^4}$ |
9.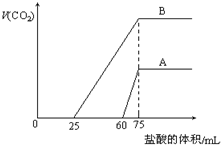 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )| A. | A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 Na2CO3和NaHCO3 | |
| B. | B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3- | |
| C. | B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL | |
| D. | 原NaOH溶液的物质的量浓度为1.0mol/L |
16.能证明二氧化硅是酸性氧化物的是( )
| A. | 二氧化硅溶于水得到相应的酸 | |
| B. | 二氧化硅是非金属氧化物 | |
| C. | 二氧化硅与强碱溶液反应只生成盐和水 | |
| D. | 二氧化硅与氢氟酸反应 |
13.下列物质既能导电又属电解质的是( )
| A. | 硝酸钾(溶液) | B. | 硫酸铜(固体) | C. | 高温熔融氯化钠 | D. | 乙醇 |
 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X是固体,B和G是液体,其余均为气体.根据如图关系推断:
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X是固体,B和G是液体,其余均为气体.根据如图关系推断: