题目内容
19.一定温度下,可逆反应A(气)+3B(气)?2C(气)达到平衡的标志是( )| A. | 单位时间生成n摩尔A,同时生成3n摩尔B | |
| B. | A,B,C的浓度不再变化 | |
| C. | A,B,C的分子数之比为1:3:2 | |
| D. | V正=V逆=0 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、从反应发生就有单位时间生成n摩尔A,同时生成3n摩尔B,只反映的是逆反应,未体现正与逆的关系,故A错误;
B、A,B,C的浓度不再变化,说明达平衡状态,故B正确;
C、当体系达平衡状态时,A,B,C的分子数之比可能为1:3:2,也可能不等,与各物质的初始浓度及转化率有关,故C错误;
D、是动态平衡,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案
相关题目
9.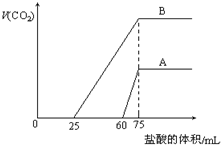 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )| A. | A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 Na2CO3和NaHCO3 | |
| B. | B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3- | |
| C. | B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL | |
| D. | 原NaOH溶液的物质的量浓度为1.0mol/L |
10.把0.05mol NaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是( )
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 CH3COOH溶液 | D. | 0.5 mol•L-1 KCl溶液 |
7.某电中性溶液中含有K+、Mg2+、Cl-、SO42-四种离子,其中K+、Mg2+、Cl-的个数比为5:2:3,则溶液中Mg2+与SO42-的个数比为( )
| A. | 1:2 | B. | 1:3 | C. | 2:3 | D. | 3:5 |
4.只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂是( )
| A. | Fe(NO3)3溶液 | B. | FeCl2溶液 | C. | BaCl2溶液 | D. | FeCl3溶液 |
11.对于任意一个化学平衡体系,采取下列措施,一定会使平衡发生移动的是( )
| A. | 加入一种反应物 | B. | 增大体系的压强 | C. | 升高温度 | D. | 扩大容器体积 |
8.用CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
| A. | 由反应①知CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 0.2 mol CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.60 mol |
 如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X是固体,B和G是液体,其余均为气体.根据如图关系推断:
如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出.常温下X是固体,B和G是液体,其余均为气体.根据如图关系推断: (C)
(C) (D)
(D)
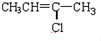 (G)
(G)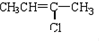 (H)
(H)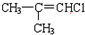
 (J)
(J)