题目内容
17.航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置,它可直接将化学能转化为电能,该电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-═CO32-+3H2O(1)负极上的电极反应为CH4+10OH--8e-=CO32-+7H2O.
(2)消耗标准状况下5.6LO2时,有1mol电子发生转移.
(3)开始放电时,正极附近溶液的pH增大(填“增大”、“减小”或“不变”)
分析 (1)该燃料电池中,负极上燃料甲烷失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子;
(2)根据氧气和转移电子正极的关系式计算转移电子物质的量;
(3)放电时,正极附近生成氢氧根离子导致氢氧根离子浓度增大.
解答 解:(1)该燃料电池中,负极上燃料甲烷失电子和氢氧根离子反应生成碳酸根离子和水,正极上氧气得电子和水反应生成氢氧根离子,正负极反应式分别为:2H2O+O2+4e-=4OH-、CH4+10OH--8e-=CO32-+7H2O,故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2)氧气物质的量==0.25mol,根据2H2O+O2+4e-=4OH-知,转移电子物质的量=4n(O2)=4×0.25mol=1mol,故答案为:1;
(3)放电时,正极附近生成氢氧根离子导致氢氧根离子浓度增大,则溶液的pH增大,故答案为:增大.
点评 本题考查化学电源新型电池,明确各个电极上发生的反应是解本题关键,所有的燃料电池中通入燃料的电极是负极、通入氧化剂的电极是正极,难点是电极反应式的书写.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
7.对平衡CO2(g)?CO2(aq);△H<0,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
| A. | 升温增压 | B. | 降温减压 | C. | 升温减压 | D. | 降温增压 |
8.在pH=1的含Ba2+ 的溶液中,还能大量存在的离子是( )
| A. | Al3+ | B. | ClO- | C. | Cl- | D. | SO42- |
5. 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 燃料电池系统产生的能量实际上来自于水 | |
| B. | 该能量转化系统中的水也是可能循环的 | |
| C. | 水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ | |
| D. | 燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
12.物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
| A. | NH4NO3 | B. | NH4HSO4 | C. | CH3COONH4 | D. | NH4HCO3 |
2.某短跑运动员体重70kg,起跑时以1/7秒冲出1m远,消耗的能量为6860J,其能量全部由消耗体内葡萄糖提供,热化学方程式为C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(1)△H=-2804kJ•mol-1,则所消耗葡萄糖的质量为( )
| A. | 0.22g | B. | 0.55g | C. | 0.44g | D. | 0.66g |
9.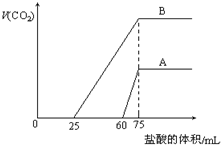 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )| A. | A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 Na2CO3和NaHCO3 | |
| B. | B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3- | |
| C. | B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL | |
| D. | 原NaOH溶液的物质的量浓度为1.0mol/L |
7.某电中性溶液中含有K+、Mg2+、Cl-、SO42-四种离子,其中K+、Mg2+、Cl-的个数比为5:2:3,则溶液中Mg2+与SO42-的个数比为( )
| A. | 1:2 | B. | 1:3 | C. | 2:3 | D. | 3:5 |