题目内容
20.已知:灰锡(以粉末状存在)和白锡是锡的两种同素异形体.Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H>0; 下列说法正确的是( )| A. | 白锡比灰锡稳定 | |
| B. | 在常温下锡以灰锡状态存在 | |
| C. | 灰锡转化为白锡的反应是放热反应 | |
| D. | 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 |
分析 A、根据能量越低越稳定判断;
B、根据反应条件常温下以白锡状态存在;
C、根据反应的焓变来确定反应是吸热还是放热;
D、根据反应③当温度低于13.2℃的环境时Sn的转化来判断.
解答 解:A、根据Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H>0,则灰锡转化为白锡的反应是吸热反应,则灰锡能量低,稳定,故A错误;
B、根据Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H>0,则锡在常温下以白锡状态存在,故B错误;
C、根据Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H>0,焓变大于0,所以灰锡转为白锡的反应是吸热反应,故C错误;
D、根据Sn(s、灰)$?_{<13.2℃}^{>13.2℃}$Sn(s、白)△H>0,当温度低于13.2℃的环境时,会自行毁坏,故D正确.
故选D.
点评 本题考查学生盖斯定律的应用以及物质的能量和其稳定性之间的关系,可以根据所学知识进行回答,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列化学方程式书写正确的是( )
| A. | 2Na2O2+2H2O═4NaOH | |
| B. | 2S+3O2═2SO3 | |
| C. | 3NO2+2H2O═3HNO3 | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
8.在pH=1的含Ba2+ 的溶液中,还能大量存在的离子是( )
| A. | Al3+ | B. | ClO- | C. | Cl- | D. | SO42- |
15.下列离子方程式中,正确的是( )
| A. | FeSO4溶液与H2O2溶液混合:Fe2++2H2O2+4H+=Fe3++4 H2O | |
| B. | 小苏打溶液与稀硫酸混合:CO32-+2 H+=CO2↑+H2O | |
| C. | 大理石溶解于醋酸:CaCO3+2 H+=Ca2++CO2↑+H2O | |
| D. | 明矾溶液水解:Al3++3 H2O?Al(OH)3+3H+ | |
| E. | 氢氧化铁与氢碘酸反应:Fe(OH)3+3 H+=Fe3++3H2O |
5. 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 燃料电池系统产生的能量实际上来自于水 | |
| B. | 该能量转化系统中的水也是可能循环的 | |
| C. | 水电解系统中的阳极反应:4OH--4e-=2H2O+O2↑ | |
| D. | 燃料电池放电时的负极反应:H2-2e-+2OH-=2H2O |
12.物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
| A. | NH4NO3 | B. | NH4HSO4 | C. | CH3COONH4 | D. | NH4HCO3 |
9.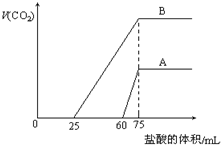 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )| A. | A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 Na2CO3和NaHCO3 | |
| B. | B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3- | |
| C. | B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL | |
| D. | 原NaOH溶液的物质的量浓度为1.0mol/L |
10.把0.05mol NaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是( )
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 CH3COOH溶液 | D. | 0.5 mol•L-1 KCl溶液 |