题目内容
1.8NH3+3Cl2═6NH4Cl+N2的反应中,若有8mol的NH3被氧化,则( )| A. | 有3 molCl2被还原 | B. | 氧化产物为1mol | ||
| C. | 氧化产物为8mol | D. | 生成N2 4mol |
分析 在8NH3+3Cl2=6NH4Cl+N2反应中,氯气中氯元素化合价由0价降低为-1价,氨气中氮元素化合价由-3价升高为0价,根据产物中氮元素化合价可知,参加反应的氨气中有$\frac{1}{4}$的起还原剂作用,$\frac{3}{4}$的氨气中氮元素化合价不变,仅作为反应物参加反应,以此解答.
解答 解:在8NH3+3Cl2=6NH4Cl+N2反应中,氯气中氯元素化合价由0价降低为-1价,氯元素被还原,氨气中氮元素化合价由-3价升高为0价,氮元素被氧化,由方程式可知,当有1molN2生成时,有8molNH3参加反应,其中有2molNH3被氧化,则有2mol N2生成,发生氧化反应的NH3的物质的量是4mol.
故选D.
点评 本题考查氧化还原反应概念及计算,侧重于学生的分析能力的考查,难度不大,关键根据化合价变化判断.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
12.物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
| A. | NH4NO3 | B. | NH4HSO4 | C. | CH3COONH4 | D. | NH4HCO3 |
9.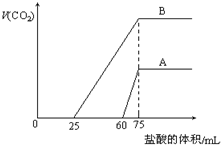 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )| A. | A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 Na2CO3和NaHCO3 | |
| B. | B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3- | |
| C. | B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL | |
| D. | 原NaOH溶液的物质的量浓度为1.0mol/L |
16.能证明二氧化硅是酸性氧化物的是( )
| A. | 二氧化硅溶于水得到相应的酸 | |
| B. | 二氧化硅是非金属氧化物 | |
| C. | 二氧化硅与强碱溶液反应只生成盐和水 | |
| D. | 二氧化硅与氢氟酸反应 |
13.下列物质既能导电又属电解质的是( )
| A. | 硝酸钾(溶液) | B. | 硫酸铜(固体) | C. | 高温熔融氯化钠 | D. | 乙醇 |
10.把0.05mol NaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是( )
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 CH3COOH溶液 | D. | 0.5 mol•L-1 KCl溶液 |
11.对于任意一个化学平衡体系,采取下列措施,一定会使平衡发生移动的是( )
| A. | 加入一种反应物 | B. | 增大体系的压强 | C. | 升高温度 | D. | 扩大容器体积 |