题目内容
18.(1)下列物质:①Na2SO4 ②HNO3 ③KClO3 ④NaHCO3⑤Ar ⑥H2 ⑦H2O ⑧NaOH属于酸的是:② 属于碱的是:⑧ 属于氧化物的是:⑦(填序号)
(2)有以下几种物质 ①乙醇 ②MgCl2晶体 ③蔗糖 ④铜 ⑤食盐水 ⑥BaSO4 请填空回答(填序号).
①以上物质中属于电解质的是②⑥
②以上物质中属于非电解质的是①③.
分析 (1)酸是指在水溶液中电离时产生的阳离子全部是氢离子的化合物;碱是指在水溶液中电离出的阴离子全部是氢氧根离子的化合物;
电解质是在熔融状态或水溶液中能导电的化合物;非电解质在熔融状态下和水溶液中不能导电的化合物;
氧化物是由两种元素构成,其中一种是氧元素的化合物;
(2)电解质是在熔融状态或水溶液中能导电的化合物;非电解质在熔融状态下和水溶液中不能导电的化合物.
解答 解:(1)②HNO3在水溶液中电离时产生的阳离子全部是氢离子,属于酸;⑧NaOH 在水溶液中电离出的阴离子全部是氢氧根离子,属于碱,⑦H2O 是由H元素和O元素构成的化合物属于氧化物;
故答案为:②;⑧;⑦;
(2)①在水溶液里或熔融状态下能导电的化合物是电解质.
②MgCl2晶体在水溶液能电离出自由移动的离子,所以其水溶液能导电,故MgCl2晶体是电解质⑥BaSO4在熔融状态下能电离出自由移动的离子,在熔融状态下能导电,所以是电解质.
故答案为:②⑥.
②在水溶液里和熔融状态下都不能导电的化合物是非电解质.①乙醇、③蔗糖在水溶液里和熔融状态下都不能电离出自由移动的离子,所以是非电解质.
故答案为:①③.
点评 本题考查学生物质的分类以及酸、碱、氧化物、电解质、非电解质的概念等知识,属于基本知识的考查,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
8.在pH=1的含Ba2+ 的溶液中,还能大量存在的离子是( )
| A. | Al3+ | B. | ClO- | C. | Cl- | D. | SO42- |
9.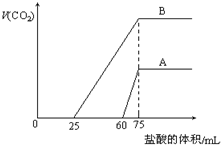 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )| A. | A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 Na2CO3和NaHCO3 | |
| B. | B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3- | |
| C. | B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL | |
| D. | 原NaOH溶液的物质的量浓度为1.0mol/L |
13.下列物质既能导电又属电解质的是( )
| A. | 硝酸钾(溶液) | B. | 硫酸铜(固体) | C. | 高温熔融氯化钠 | D. | 乙醇 |
3.在某温度时,测得纯水中的[H+]=2.0×10-7 mol•L-1,则[OH-]为( )
| A. | 2.0×10-7 mol•L-1 | B. | 0.1×10-7 mol•L-1 | ||
| C. | 1.0×10-14/2.0×10-7 mol•L-1 | D. | 无法确定 |
10.把0.05mol NaOH固体分别加入到100mL下列液体中,溶液的导电能力变化最小的是( )
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 CH3COOH溶液 | D. | 0.5 mol•L-1 KCl溶液 |
7.某电中性溶液中含有K+、Mg2+、Cl-、SO42-四种离子,其中K+、Mg2+、Cl-的个数比为5:2:3,则溶液中Mg2+与SO42-的个数比为( )
| A. | 1:2 | B. | 1:3 | C. | 2:3 | D. | 3:5 |
8.用CH4催化还原NOx可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
下列说法不正确的是( )
| A. | 由反应①知CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 0.2 mol CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.60 mol |