题目内容
8. Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与接触面积 有关.
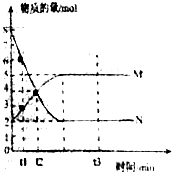
Ⅱ.一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中$\frac{a}{b}$=$\frac{2}{1}$
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1
(3)平衡时,N的转化率为75%.
(4)下列叙述中能说明上述反应达到平衡状态的是CE
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化.
分析 Ⅰ、(1)二氧化锰是过氧化氢分解的催化剂,由带火星木条复燃,可知产物,由此可写出方程式;由实验现象可知,反应放热还是吸热;
(2)由实验现象可知催化剂作用大小的影响因素.
Ⅱ、(1)化学方程式的系数之比等于各物质的物质的量的变化量之比;
(2)根据v=$\frac{\frac{△n}{V}}{△t}$计算v(M);
(3)由图可知,N为反应物,N的起始物质的量为8mol,平衡时参加反应的N的物质的量为8mol-2mol=6mol,在结合转化率定义计算;
(4)当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断.
解答 解:Ⅰ、(1)H2O2在二氧化锰作用下发生反应的化学反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,根据触摸试管的感觉可知,该反应为放热反应;
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑; 放热;
(2)因在其他条件相同时,粉末状二氧化锰比块状二氧化锰反应所需时间短,说明接触面积对反应速率有影响,
故答案为:接触面积;
Ⅱ、(1)参加反应的N的物质的量为8mol-2mol=6mol,生成的M的物质的量是5mol-2mol=3mol,所以此反应的化学方程式中$\frac{a}{b}$=$\frac{2}{1}$,故答案为:$\frac{2}{1}$;
(2)由图可知,t1到t2时刻M的物质的量变化为4mol-3mol=1mol,v=$\frac{\frac{(4-3)mol}{VL}}{({t}_{2}-{t}_{1})min}$═$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1,故答案为:$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1;
(3)由图可知,N为反应物,N的起始物质的量为8mol,平衡时参加反应的N的物质的量为8mol-2mol=6mol,故N的转化率为$\frac{6mol}{8mol}$×100%=75%,故答案为:75%;
(4)A.平衡时反应混合物各组分的物质的量不变,但各组分的物质的量不一定相等,故A错误;
B.混合气体的总质量始终不变,混合气体总质量不变不能说明到达平衡,故B错误;
C.由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的总物质的量不随时间的变化而变化,说明到达平衡,故C正确;
D.单位时间内消耗amolN,同时生成bmolM,都表示正反应速率,反应始终按此关系进行,不能说明到达平衡,故D错误;
E.由于a≠b,随反应进行混合气体总物质的量发生变化,混合气体的压强不随时间的变化而变化,说明混合气体总的物质的量再不变,说明反应到达平衡,故E正确;
故答案为:CE.
点评 本题考查化学反应速率计算、化学平衡计算、化学平衡状态判断,题目难度中等,注意把握由图象判断化学方程式的方法以及反应现象与结论的推断.

| A. | H2 D2 | B. | 14N 14C | C. | 16O 17O | D. | 金刚石 石墨 |
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A. | 与稀盐酸反应的剧烈程度:L单质<Q单质 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 热稳定性:H2T<H2R | |
| D. | L2+与R2-的核外电子数相等 |
| A. | 放热91.5 kJ | B. | 放热183 kJ | C. | 吸热183 kJ | D. | 吸热91.5 kJ |
| A. | Te与H2的反应比S与H2反应困难 | B. | TeO3对应的水化物是一种酸 | ||
| C. | H2Te的还原性比H2S弱 | D. | 有-2、+4、+6三种化合价 |
| A. | Cl-、Br-、CrO42- | B. | CrO42-、Br-、Cl- | C. | Br-、Cl-、CrO42- | D. | Br-、CrO42-、Cl- |
(1)常 温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,完成以下实验设计表.
| 实验 编号 | 温度 | 初始pH | 0.1mol/L草酸溶液/mL | 0.01mol/LKMnO4溶液体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | 50 | 10 | t3 |
(3)若t1<t2,则根据实验①和②得到的结论是溶液的pH对该反应的速率有影响.
(4)请你设计实验验证MnSO4对该反应起催化作用,完成下表中内容.
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
往反应混合液中加入少量MnSO4固体,控制其他反应条件与实验①相同,进行对比实验 | 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题: .
. 实验室用图示装置制取乙酸乙酯.
实验室用图示装置制取乙酸乙酯.