题目内容
17.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9×10-11.某溶液中含有Cl-、Br- 和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )| A. | Cl-、Br-、CrO42- | B. | CrO42-、Br-、Cl- | C. | Br-、Cl-、CrO42- | D. | Br-、CrO42-、Cl- |
分析 析出沉淀时,AgCl溶液中c(Ag+)=$\frac{{K}_{sp}(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.010}$mol/L,AgBr溶液中c(Ag+)=$\frac{{K}_{sp}(AgBr)}{c(B{r}^{-})}$=$\frac{7.7×1{0}^{-13}}{0.010}$mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-11}}{0.010}}$mol/L,c(Ag+)越小,则越先生成沉淀,据此进行判断.
解答 解:析出沉淀时,银离子浓度至少为:AgCl溶液中c(Ag+)=$\frac{{K}_{sp}(AgCl)}{c(C{l}^{-})}$=$\frac{1.56×1{0}^{-10}}{0.010}$mol/L=1.56×10-8mol/L,
AgBr溶液中c(Ag+)=$\frac{{K}_{sp}(AgBr)}{c(B{r}^{-})}$=$\frac{7.7×1{0}^{-13}}{0.010}$mol/L=7.7×10-11mol/L,
Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{9.0×1{0}^{-11}}{0.010}}$mol/L=3$\sqrt{10}$×10-5mol/L,
c(Ag+)越小,则越先生成沉淀,所以种阴离子产生沉淀的先后顺序为:Br-、Cl-、CrO42-,
故选C.
点评 本题考查难溶电解质的溶解平衡的计算与判断,题目难度中等,注意根据溶解度判断生成沉淀的先后顺序,需要明确组成不相似的物质,不能直接根据溶度积判断,为易错点.

 阅读快车系列答案
阅读快车系列答案| A. | ①②③④ | B. | ②①③④ | C. | ②④①③ | D. | ③④①② |
 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与接触面积 有关.
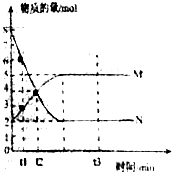
Ⅱ.一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中$\frac{a}{b}$=$\frac{2}{1}$
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1
(3)平衡时,N的转化率为75%.
(4)下列叙述中能说明上述反应达到平衡状态的是CE
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化.
| A. | X的气态氢化物的稳定性比甲烷强 | B. | X的最高价氧化物是XO2 | ||
| C. | X应为非金属元素 | D. | X的最高价氧化物的水化物是强酸 |
| A. | 若完全燃烧,1 mol雄酮(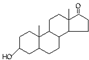 )比雌酮( )比雌酮(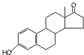 )多消耗2 mol O2 )多消耗2 mol O2 | |
| B. | 苯分子中的一个碳原子被一个氮原子代替,则新分子的式量为79 | |
| C. | 蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 | |
| D. | 只用溴水一种试剂不能鉴别甲苯、己烯、乙醇、四氯化碳四种液体 |
| A. | 单位时间内生成n mol A,同时生成2n mol C | |
| B. | A、B、C的浓度相等 | |
| C. | 单位时间内生成n mol A,同时生成3n mol B | |
| D. | A、B、C的分子数之比为1:3:2 |
| A. | 1mL | B. | 4mL | C. | 5mL | D. | 7mL |
Al4C3+12H2O→4Al(OH)3+3CH4↑
Mg2C3+4H2O→2Mg(OH)2+C3H4↑
完成下列计算:
(1)如果需要制取10.08L的乙炔(标准状况下),至少需要30g CaC2含量为96%的电石.
(2)金属碳化物Al4C3与Mg2C3组成的混合物与一定量的水反应,实验数据如下:
| 实验组号 | ① | ② | ③ | ④ |
| 碳化物(g) | 7.8 | 15.6 | 23.4 | 31.2 |
| 水(mL) | 18 | 18 | a | a |
| 气体(L/标况) | 2.8 | 5.6 | 7 | 7 |
①混合物中Al4C3与Mg2C3的物质的量之比=1:2;
②a=22.5g;
(3)甲烷通过激光分解可制得乙炔.
主反应:2CH4→C2H2+3H2;副反应:CH4→C(s)+2H2.
在一烧瓶中加入Al4C3与CaC2组成的混合物,再向烧杯中加入足量的水,充分反应后,烧瓶质量减轻了7.4g,同时收集到气体8.96L(折算为标况).通过激光分解后,得到的气体的平均相对分子质量为11,同时有0.03g碳生成,计算甲烷的分解率.
 .
.