题目内容
20.Te(碲)元素位于是第5周期ⅥA族,根据同族元素的性质推断,碲不可能具有的性质是( )| A. | Te与H2的反应比S与H2反应困难 | B. | TeO3对应的水化物是一种酸 | ||
| C. | H2Te的还原性比H2S弱 | D. | 有-2、+4、+6三种化合价 |
分析 A.同主族自上而下非金属性减弱,与氢气反应更困难;
B.Te为非金属性元素,结合三氧化硫对应的水化物硫酸解答;
C.同主族自上而下非金属性减弱,氢化物的还原性增强;
D.结合S元素具有的化合价判断.
解答 解:A.同主族自上而下非金属性减弱,故Te与H2的反应比S与H2反应困难,故A正确;
B.S、Te同主族,且Te为非金属性元素,三氧化硫对应的水化物是酸,则TeO3对应的水化物也是一种酸,故B正确;
C.同主族自上而下非金属性减弱,氢化物的还原性增强,故H2Te的还原性比H2S强,故C错误;
D.同主族元素含有相似的性质,S元素有-2、+4、+6化合价,故Te也有-2、+4、+6化合价,故D正确,
故选C.
点评 本题考查同主族元素化合物性质的相似性与递变性,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
10.已知: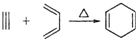 ,如果要合成
,如果要合成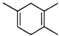 所用的原始原料可以是( )
所用的原始原料可以是( )
 ,如果要合成
,如果要合成 所用的原始原料可以是( )
所用的原始原料可以是( )| A. | 2-甲基-l,3-丁二烯 和 2-丁炔 | B. | 1,3-戊二烯 和 2-丁炔 | ||
| C. | 2,3-二甲基-1,3-戊二烯 和 乙炔 | D. | 2,3-二甲基-l,3-丁二烯 和 丙炔 |
8. Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
(1)写出上述实验中发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应是放热反应(填放热或吸热).
(2)实验结果表明,催化剂的催化效果与接触面积 有关.
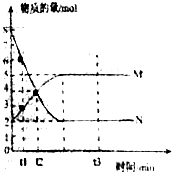
Ⅱ.一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中$\frac{a}{b}$=$\frac{2}{1}$
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1
(3)平衡时,N的转化率为75%.
(4)下列叙述中能说明上述反应达到平衡状态的是CE
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化.
 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与接触面积 有关.
Ⅱ.一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中$\frac{a}{b}$=$\frac{2}{1}$
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1
(3)平衡时,N的转化率为75%.
(4)下列叙述中能说明上述反应达到平衡状态的是CE
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化.
15.与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是( )
| A. | Na2S | B. | CCl4 | C. | KCl | D. | Na2O |
5.若发现114号元素X,它的最外层有4个电子,则下列有关它的叙述正确的是( )
| A. | X的气态氢化物的稳定性比甲烷强 | B. | X的最高价氧化物是XO2 | ||
| C. | X应为非金属元素 | D. | X的最高价氧化物的水化物是强酸 |
9.在一定温度下,可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | 单位时间内生成n mol A,同时生成2n mol C | |
| B. | A、B、C的浓度相等 | |
| C. | 单位时间内生成n mol A,同时生成3n mol B | |
| D. | A、B、C的分子数之比为1:3:2 |
10.短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,下列说法正确的( )
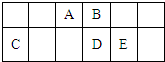

| A. | 原子半径的大小顺序为:rA>rB>rC>rD>rE | |
| B. | 元素D的最高价氧化物对应的水化物的酸性比E的强 | |
| C. | A、D两种元素在自然界中都存在相应的单质 | |
| D. | C的最高价氧化物的水化物与E的最高价氧化物的水化物之间不能发生反应 |
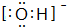 .
.