题目内容
3.L-T 5种短周期元素的信息如下表,有关叙述正确的是( )| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、+4、-2 | -2 |
| A. | 与稀盐酸反应的剧烈程度:L单质<Q单质 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 热稳定性:H2T<H2R | |
| D. | L2+与R2-的核外电子数相等 |
分析 短周期元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg、Q为Be;R、T都-2价,处于ⅥA族,且Q有+6价,原子半径较大,故Q为S、T为O;M只有+3价,处于ⅢA族,原子半径大于S,故M为Al,据此解答.
解答 解:短周期元素,L、Q都有+2价,处于ⅡA族,原子半径L>Q,则L为Mg、Q为Be;R、T都-2价,处于ⅥA族,且Q有+6价,原子半径较大,故Q为S、T为O;M只有+3价,处于ⅢA族,原子半径大于S,故M为Al,
A.金属性Mg>Be,故与稀盐酸反应的剧烈程度:Mg>Be,故A错误;
B.氧化铝属于两性氧化物,故B正确;
C.非金属性O>S,故热稳定性:H2O<H2S,故C错误;
D.Mg2+的核外电子数为10,S2-的核外电子数是18,故D错误,
故选B.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题的关键,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
18.下列实验方案能够达到预期目的是( )
| A. | 乙醇的消去反应可用水浴加热 | |
| B. | 检验无水乙醇中是否含有少量水:加硫酸铜晶体观察现象 | |
| C. | 区别苯和乙苯:加酸性高锰酸钾溶液,振荡,观察现象 | |
| D. | 检验氯代烃中的氯元素时,可先加入硝酸溶液,再加入硝酸银溶液来进行检验 |
8. Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
(1)写出上述实验中发生反应的化学方程式:2H2O22H2O+O2↑,该反应是放热反应(填放热或吸热).
(2)实验结果表明,催化剂的催化效果与接触面积 有关.
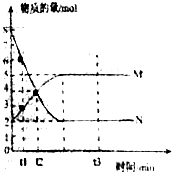
Ⅱ.一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中=
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:mol•L-1•min-1
(3)平衡时,N的转化率为75%.
(4)下列叙述中能说明上述反应达到平衡状态的是CE
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化.
 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与接触面积 有关.
Ⅱ.一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中=
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:mol•L-1•min-1
(3)平衡时,N的转化率为75%.
(4)下列叙述中能说明上述反应达到平衡状态的是CE
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化.
15.与Ne的核外电子排布相同的离子跟与Ar的核外电子排布相同的离子所形成的化合物是( )
| A. | Na2S | B. | CCl4 | C. | KCl | D. | Na2O |
13.下列关于氯气的说法不正确的是( )
| A. | 新制氯水可使紫色石蕊试液先变红后褪色 | |
| B. | 将鲜花放入盛有氯气的集气瓶中,鲜花褪色,说明Cl2具有漂白性 | |
| C. | 可以用浓硫酸除去氯气中的水蒸气 | |
| D. | 氢气在氯气中燃烧产生苍白色火焰瓶口有白雾 |
 .
.