题目内容
18. 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:(1)镓为元素周期表第31号元素,镓原子价层电子排布图为
 .
.(2)氮所在主族中第一电离能最大的元素是N(填元素符号,下同),镓所在主族中电负性最大的元素是B.
(3)传统的氮化镓制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式为GaCl3+NH3=GaN+3HCl.
(4)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以共价键相结合,氮化镓属于原子晶体晶体.
(5)如图是氮化镓的晶胞模型:
①氮化镓中镓原子的杂化方式为sp3,氮原子的配位数为4.
②氮化镓为立方晶胞,氮化镓的密度为d g/cm3.列出计算氮化镓晶胞边长a的表达式:a=$\root{3}{\frac{168}{ρ•{N}_{A}}}$cm.
分析 (1)根据镓原子序数,写出核外电子排布式,找出价电子,从而写出其基态时的价层电子排布图;
(2)根据元素周期律,同主族元素从个向下,第一电离能逐渐减小,电负性逐渐减小,据此判断;
(3)根据反应物和生成物,利用元素守恒写出化学方程式;
(4)利用该晶体与金刚石具有相似的晶体结构,而金刚石中碳原子通过共价键相互作用形成了原子晶体,据此答题;
(5)①根据其形成的共价键数目判断杂化方式,观察晶胞结构图判断配位数;
②利用密度求出晶胞的体积,再求得晶胞边长.
解答 解:(1)镓原子序数为31,所以其核外电子排布式为:1s22s22p63s33p63d104s24p1,最外层电子为价电子,价电子排布式为:4s24p1,即4s轨道有一对自旋相反的电子,4p轨道只有一个电子,
故答案为: ;
;
(2)第一电离能同主族从上到下,越来越小,N元素为该主族最上面的元素,第一电离能最大;电负性从上到下,越来越小,镓所在族最上面的元素为B,
故答案为:N;B;
(3)反应物为NH3和GaCl3,生成物为GaN,不难判断出另一种产物为HCl,根据原子守恒写出化学方程式,
故答案为:GaCl3+NH3=GaN+3HCl;
(4)由于氮化镓与金刚石具有相似的晶体结构,所以氮化镓为原子晶体,原子之间以共价键结合在一起,
故答案为:共价键、原子晶体;
(5)①根据晶胞可以看到Ga可以相邻的四个N形成共价键,即Ga形成四条共价键,所以杂化类型为sp3杂化;观察晶胞结构发现N原子周围距离最近的Ga数目为4,即配位数为4,故答案为:sp3;4;
②GaN晶胞中,Ga位于顶点和体心,所以含有Ga数为:$8×\frac{1}{8}+1$=2,N原子位于棱和体心,所以N数为:$4×\frac{1}{4}+1$=2,GaN晶胞中含有两个GaN,晶胞边长为$\root{3}{\frac{m}{ρ}}$=$\root{3}{\frac{\frac{2×84}{{N}_{A}}}{ρ}}$=$\root{3}{\frac{168}{ρ•{N}_{A}}}$,
故答案为:$\root{3}{\frac{168}{ρ•{N}_{A}}}$.
点评 本题综合考查物质结构与性质,涉及核外电子排布规律、电离能、杂化理论、分子结构、晶胞结构,为典型习题.

 阶梯计算系列答案
阶梯计算系列答案| A. |  | B. |  | C. | 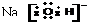 | D. |  |
 ,如果要合成
,如果要合成 所用的原始原料可以是( )
所用的原始原料可以是( )| A. | 2-甲基-l,3-丁二烯 和 2-丁炔 | B. | 1,3-戊二烯 和 2-丁炔 | ||
| C. | 2,3-二甲基-1,3-戊二烯 和 乙炔 | D. | 2,3-二甲基-l,3-丁二烯 和 丙炔 |
| A. | ①②③④ | B. | ②①③④ | C. | ②④①③ | D. | ③④①② |
 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与接触面积 有关.
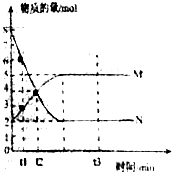
Ⅱ.一定温度下,在容积为VL的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中$\frac{a}{b}$=$\frac{2}{1}$
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:$\frac{1}{({t}_{2}-{t}_{1})V}$mol•L-1•min-1
(3)平衡时,N的转化率为75%.
(4)下列叙述中能说明上述反应达到平衡状态的是CE
A.反应中M与N的物质的量之比为1:1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化.
 过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下
过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,易分解.可用纯碱与H2O2反应制取,反应方程式为:2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2(s)△H<0,如图是制取过碳酸钠 的示意图,步骤如下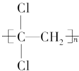 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2(写结构简式)发生加聚反应生成的.
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2(写结构简式)发生加聚反应生成的.