题目内容
3.铜在自然界存在于多种矿石中.(Ⅰ)以硅孔雀石(主要成分为CuSiO3•2H2O,含少量SiO2、FeCO3、Fe2O3等杂质)为原料制取硫酸铜的工艺流程如下:
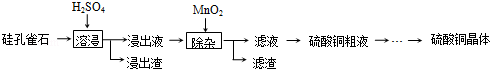
已知:Fe3+、Cu2+和Fe2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、6.7和9.7.
(1)“溶浸”中CuSiO3•2H2O和H2SO4发生反应的化学方程式CuSiO3•2H2O+H2SO4=CuSO4+H2SiO3↓+2H2O.
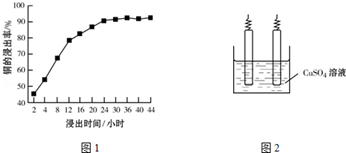
(2)“溶浸”中,选取浓度为20% H2SO4为浸出剂,铜的浸出率与浸出时间的关系见图1.由图1可得,随着浸出时间的增长,①铜的浸出率相应增加.②浸出时间超过24小时后,铜的浸出率变化不是很明显.
(3)“除杂”中,加入MnO2的作用是2Fe2++MnO2+4H+=2Fe3++2H2O+Mn2+(用离子方程式表示).“除杂”中需在搅拌下加入石灰乳以调节溶液的pH到3~4,沉淀部分杂质离子,分离得滤液.滤渣的主要成分为Fe(OH)3.
(Ⅱ)以黄铜矿(主要成分为CuFeS2)为原料炼制精铜的工艺流程如下:
黄铜矿$\stackrel{焙烧}{→}$精铜冰铜(Cu2S和FeS)$\stackrel{还原}{→}$粗铜$\stackrel{电解精炼}{→}$精铜
(4)“还原”工艺中其中一个反应为:Cu2S+2Cu2O $\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑,该反应的氧化剂是Cu2O、Cu2S.
(5)粗铜含少量Fe、Ag、Au等金属杂质,电解精炼铜时,阴极反应式为Cu2++2e-=Cu.完成图2中由粗铜电解得到精铜的示意图,并作相应标注.
分析 硅孔雀石加硫酸溶浸,发生的反应为:CuSiO3•2H2O+H2SO4=CuSO4+H2SiO3+2H2O,FeCO3、Fe2O3与硫酸反应生成二价铁和三价铁离子,则浸出液中含有二价铜、二价铁和三价铁离子,再加二氧化锰,将二价铁氧化成三价铁离子,进一步除杂最终得到硫酸铜晶体,
(1)“溶浸”中CuSiO3•2H2O和H2SO4发生生成硫酸铜、硅酸和水;
(2)根据图象分析,随着浸出时间的增长,①铜的浸出率相应增加;②浸出时间超过24小时后,铜的浸出率变化不是很明显;
(3)根据实验目的除去铁,则二氧化锰将二价铁氧化成三价铁;根据pH到3~4Fe3+完全沉淀分析;
(4)根据反应化合价降低的为氧化剂判断;
(5)电解精炼铜时,粗铜应该放在阳极,精铜为阴极,发生还原反应 Cu2++2e-=Cu,电解质溶液为硫酸铜溶液;
解答 解:硅孔雀石加硫酸溶浸,发生的反应为:CuSiO3•2H2O+H2SO4=CuSO4+H2SiO3+2H2O,FeCO3、Fe2O3与硫酸反应生成二价铁和三价铁离子,则浸出液中含有二价铜、二价铁和三价铁离子,再加二氧化锰,将二价铁氧化成三价铁离子,进一步除杂最终得到硫酸铜晶体,
(1)“溶浸”中CuSiO3•2H2O和H2SO4发生生成硫酸铜、硅酸和水,方程式为:CuSiO3•2H2O+H2SO4=CuSO4+H2SiO3↓+2H2O,
故答案为:CuSiO3•2H2O+H2SO4=CuSO4+H2SiO3↓+2H2O;
(2)根据图象变化趋势,随着浸出时间的增长,①铜的浸出率相应增加;②浸出时间超过24小时后,铜的浸出率变化不是很明显,
故答案为:①铜的浸出率相应增加;②浸出时间超过24小时后,铜的浸出率变化不是很明显;
(3)因为要将铁转化成氢氧化铁除去,则二氧化锰将二价铁氧化成三价铁,离子方程式为:2Fe2++MnO2+4H+=2Fe3++2H2O+Mn2+;pH到3~4只有Fe3+完全沉淀,所以滤渣的主要成分为氢氧化铁,
故答案为:2Fe2++MnO2+4H+=2Fe3++2H2O+Mn2+;Fe(OH)3;
(4)Cu2S+2Cu2O $\frac{\underline{\;高温\;}}{\;}$6Cu+SO2↑,化合价发生降低有Cu2O、Cu2S,所以氧化剂为:Cu2O、Cu2S,
故答案为:Cu2O、Cu2S;
(5)电解精炼铜时,粗铜应该放在阳极,精铜为阴极,发生还原反应 Cu2++2e-=Cu,电解质溶液为硫酸铜溶液,
故答案为:Cu2++2e-=Cu;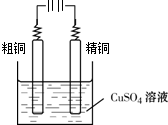 .
.
点评 本题考查铜及其化合物的性质,主要是流程分析,产物判断,电解池原理的应用,特别是阅读信息、处理信息的能力,难度稍大.

| A. | 胶体带电荷,而溶液呈电中性 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 胶体和溶液都是一种非常稳定的分散系 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
| A. | 四氯化碳和水 | B. | 苯和水 | C. | 乙酸和水 | D. | 酒精和水 |
| A. | ①⑥⑦ | B. | ③⑤⑧⑨ | C. | ③⑦⑧ | D. | ③⑦⑧⑨ |
| A. | 等物质的量的N2和CO所含分子数不一定为NA | |
| B. | S.T.P下22.4L CH4所含电子数目为10NA | |
| C. | 1molF-含质子数与电子数之和为10NA | |
| D. | 1molOH-中所含中子数为8NA |
| A. | 6 种 | B. | 8 种 | C. | 10 种 | D. | 14 种 |