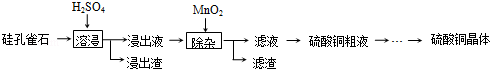
题目内容
8.少量铁粉与100mL 0.01mol/L的稀盐酸(足量)反应,反应速率太慢.为了加快此反应速率而不改变H2的总量,可使用如下方法中的:①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL 0.1mol/L盐酸 ⑨改用100mL0.1mol/L的稀硝酸( )| A. | ①⑥⑦ | B. | ③⑤⑧⑨ | C. | ③⑦⑧ | D. | ③⑦⑧⑨ |
分析 为了加快此反应速率而不改变H2的产量,少量铁粉完全反应,则可增大氢离子浓度、构成原电池、升高温度等来加快反应速率,以此来解答.
解答 解:①加H2O,氢离子浓度减小,反应速率减慢,故错误;
②加NaOH固体,氢离子浓度减小,反应速率减慢,故错误;
③滴入几滴浓盐酸,氢离子浓度增大,反应速率加快,故正确;
④加CH3COONa固体,生成醋酸,氢离子浓度减小,反应速率减慢,故错误;
⑤加NaCl溶液,氢离子浓度减小,反应速率减慢,故错误;
⑥滴入几滴硫酸铜溶液,构成原电池,反应速率加快,但Fe少量,导致生成的氢气减少,故错误;
⑦升高温度(不考虑盐酸挥发),反应速率加快,故正确;
⑧改用10mL 0.1mol/L盐酸,氢离子浓度增大,反应速率加快,故正确;
⑨改用100mL0.1mol/L的稀硝酸,反应不生成氢气,故错误.
故选C.
点评 本题考查影响反应速率的因素,明确常见的温度、浓度、原电池对反应速率的影响即可解答,注意铁粉少量完全反应,生成的氢气由铁粉决定为解答的易错点,解答中易多选⑥,题目难度不大.

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目
16.下列有关化学知识的叙述中正确的是( )
| A. | 丁达尔效应是溶液和胶体的本质区别 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 常用作水处理剂的KAl(SO4)2和漂白粉都是强电解质 | |
| D. | 232Th 转变成233U是化学变化,233U和235U的化学性质几乎相同 |
13.设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 常温下,22g CO2含有2NA个氧原子 | |
| B. | 标准状况下,22.4L的CCl4中含有的分子数为NA | |
| C. | 1mol/L的碳酸钠溶液中含Na+离子数为2NA | |
| D. | 常温下,将含0.1NA个HCl分子的氯化氢气体溶于水配成100mL溶液,所得溶液中C(H+)为1mol/L |
5.金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料.
某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序.他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象如下:下列有关三种金属的说法正确的是( )
某化学兴趣小组用实验探究Ti、Mg、Cu的活泼性顺序.他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象如下:下列有关三种金属的说法正确的是( )
| 金属学 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
| A. | 三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu | |
| B. | 若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg | |
| C. | 用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径 | |
| D. | Cu和稀盐酸不发生化学反应 |
 .
.