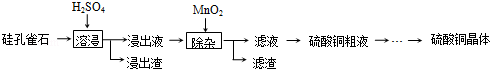
题目内容
12.从Zn、Fe(0H)3、KMn04、Ca0、稀硫酸和水等物质中.选出适当的物质作为反应物.按下列要求写出化学方程式:①化合反应:Ca0+H20=Ca(0H)2;
②无单质生成的分解反应;2Fe(0H)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe203+3H20;
③有单质生成的分解反应:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
④置换反应:Zn+H2SO4═ZnSO4+H2↑;
③复分解反应(酸与碱的反应):2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O;
上述反应中.属于氧化还原反应的是③④.
分析 ①化合反应是指由两种或两种以上物质反应生成另外一种物质的反应;
②③单质是由一种元素组成的纯净物,由一种反应物生成两种或两种以上其他物质的反应叫分解反应;
④由一种单质跟一种化合物起反应,生成另一种单质和另一种化合物的反应叫做置换反应;
⑤复分解反应主要是两种化合物相互交换成分生成另两种化合物的反应;
氧化还原反应的特征是化合价的变化,实质是电子的转移,电子从化合价升高的元素到化合价降低的元素.
解答 解:①氧化钙和水反应生成氢氧化钙属于化合反应,反应为:Ca0+H20=Ca(0H)2,
故答案为:Ca0+H20=Ca(0H)2;
②氢氧化铁受热分解生成氧化铁和水,属于无单质生成的分解反应,反应为:2Fe(0H)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe203+3H20,
故答案为:2Fe(0H)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe203+3H20;
③高锰酸钾受热分解生成锰酸钾和二氧化锰、氧气,符合有单质生成的分解反应条件,反应为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,
故答案为:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
④锌和稀硫酸生成硫酸锌和氢气,属于置换反应,反应方程式为:Zn+H2SO4═ZnSO4+H2↑,
故答案为:Zn+H2SO4═ZnSO4+H2↑;
⑤氢氧化铁和硫酸发生复分解反应生成硫酸铁和水,反应为:2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O,
故答案为:2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O;
上述反应中,③有单质生成的分解反应,④置换反应,一定属于氧化还原反应,
故答案为:③④.
点评 本题主要考查反应类型方面的知识,解答时要分析反应物和生成物的种类,然后再根据各种反应类型的概念方面进行分析、判断,从而得出正确的结论,题目难度不大.

| A. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20 mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):3OH-+2CO2═CO32-+HCO3-+H2O |
| A. | 12C和14C | B. | O2与O3 | ||
| C. | CH3COOH与CH3-O-CHO | D. | CH3CHCH2CH3与CH3CH2CH2CHCH3 |