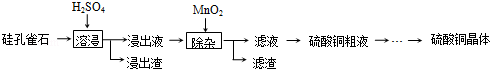
题目内容
11.某同学准备利用所学知识配制100mL 1mol•L-1Na2CO3溶液,请回答有关问题.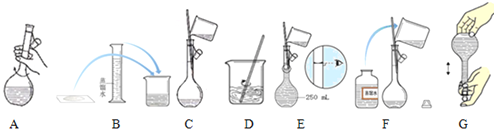
(1)计算所需Na2CO3的质量.用托盘天平称取10.6g Na2CO3固体.
(2)如图是配制一定物质的量浓度的溶液过程示意图,其正确的操作顺序为C→A→D→B→F→E→G (填字母代号 )
(3)在上述示意图中,存在错误的是 (填字母代号).该处正确应为应改为用胶头滴管定容,容量瓶规格应选择100mL
(4)准确配制好该溶液后,取出10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是0.2mol/L.
(5)若进行E步操作时加蒸馏水超过刻度线,则需重新配制.
(6)配制NaCl溶液时,下列操作情况会使结果偏高的是C.
A.移液前,容量瓶中有少量蒸馏水
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.没有用蒸馏水洗涤烧杯和玻璃棒
E.定容后,倒置容量瓶摇匀,平放静置,液面低于刻度线,再加水定容.
分析 (1)依据m=CVM计算溶质的质量;
(2)根据配制一定物质的量浓度溶液的实验操作的步骤解答;
(3)依据容量瓶规格选择方法及定容的正确操作解答;
(4)依据溶液稀释前后所含溶质的物质的量不变计算稀释后碳酸钠的物质的量浓度,1mol碳酸钠含有2mol钠离子,所以钠离子浓度为碳酸浓度两倍;
(5)操作失误,无法弥补的,必须重新配制;
(6)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制100mL 1mol•L-1Na2CO3溶液,需要碳酸钠的质量=0.1L×1mol/L×106g/mol=10.6g;
故答案为:10.6;
(2)配制一定物质的量浓度溶液的步骤是:计算、量取、稀释、冷却、移液、定容、摇匀、装瓶、贴签,正确的操作顺序为:CADBFE;
故答案为:DBFE;
(3)配制100mL 1mol•L-1Na2CO3溶液,应选择100mL容量瓶,定容时,先直接向容量瓶中加入蒸馏水到离刻度线1-2cm处,改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切,所以错误的为E;应改为用胶头滴管定容,容量瓶规格应选择100mL;
故答案为:E;应改为用胶头滴管定容,容量瓶规格应选择100mL;
(4)设稀释后碳酸钠浓度为C,则依据溶液稀释前后所含溶质的物质的量不变计算,C×100ml=1mol/L×10mL,解得C=0.1mol/L,1mol碳酸钠含有2mol钠离子,所以钠离子浓度为碳酸浓度两倍,所以钠离子的物质的量浓度为0.2mol/L;
故答案为:0.2mol/L;
(5)若进行E步操作时加蒸馏水超过刻度线,操作失误且无法弥补,必须重新配制;
故答案为:重新配制;
(6)A.移液前,容量瓶中有少量蒸馏水对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故A不选;
B.溶解搅拌时有液体飞溅,导致溶质的物质的量偏低,溶液的物质的量浓度偏低,故B不选;
C.定容时俯视容量瓶瓶颈刻度线,导致溶液体积偏小,溶液浓度偏高,故C选;
D.没有用蒸馏水洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低,故D不选;
E.定容后,倒置容量瓶摇匀,平放静置,液面低于刻度线,再加水定容,导致溶液体积偏大,溶液用到偏低,故E不选;
故选:C.
点评 本题考查了一定物质的量浓度溶液的配制以及误差分析,明确配制的一般步骤和原理是解题关键,注意误差分析的方法和技巧.

| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 饱和NaCl溶液中通入HCl气体有晶体析出 | |
| C. | 500℃左右比室温更有利于合成氨反应 | |
| D. | 滴有酚酞试液的氨水中加入少量醋酸铵晶体,溶液红色变浅 |
| A. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20 mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):3OH-+2CO2═CO32-+HCO3-+H2O |
| A. | 氢气通过灼热的氧化铜 H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | |
| B. | 二氧化碳通过Na2O2粉末 2Na2O2+2CO2═2Na2CO3+O2 | |
| C. | 铝与Fe2O3发生铝热反应 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 将锌粒投入Cu(NO3)2溶液 Zn+Cu(NO3)2═Zn(NO3)2+Cu |
| A. | 丁达尔效应是溶液和胶体的本质区别 | |
| B. | 碱性氧化物一定是金属氧化物 | |
| C. | 常用作水处理剂的KAl(SO4)2和漂白粉都是强电解质 | |
| D. | 232Th 转变成233U是化学变化,233U和235U的化学性质几乎相同 |
| A. | 12C和14C | B. | O2与O3 | ||
| C. | CH3COOH与CH3-O-CHO | D. | CH3CHCH2CH3与CH3CH2CH2CHCH3 |