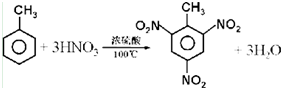
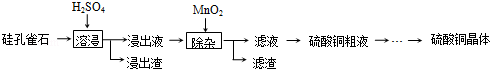
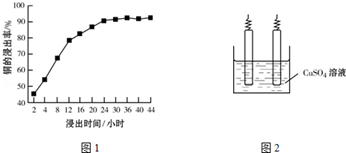
题目内容
14.某学生欲配制6.0mol•L-1的H2SO4溶液950mL,实验室有三种不同浓度的硫酸:①480mL 0.5mol•L-1 的硫酸;②150mL 25%的硫酸(ρ=1.18g•mL-1);③足量的18mol•L-1 的硫酸.有三种规格的容量瓶:250mL、500mL、1000mL.老师要求把①②两种硫酸全部用完,不足的部分由③来补充. 请回答下列问题:(1)实验所用25%的硫酸的物质的量浓度为3.0mol•L-1(保留1位小数).
(2)配制该硫酸溶液应选用容量瓶的规格为1000mL.
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的 18mol•L-1的硫酸295mL,沿玻璃棒倒入上述混合液中.并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.用适量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
E.轻轻摇动,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面最低点恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀.
(4)如果省略操作D,对所配溶液浓度有何影响?偏小(填“偏大”“偏小”或“无影响”).
(5)进行操作C前还需注意将稀释后的硫酸冷却.
分析 (1)依据c=$\frac{1000ρω%}{M}$计算25%的硫酸的物质的量浓度,设需要浓硫酸的体积为V,依据稀释前后溶液中所含溶质的物质的量不变计算所需浓硫酸的体积V;
(2)依据所配溶液的体积选择合适的容量瓶;
(3)B.所配溶液所需的硫酸的物质的量等于①②两种硫酸溶液含硫酸的总的物质的量加③提供硫酸的物质的量,所以③提供硫酸的物质的量等于所需硫酸总的物质的量减去①②两种硫酸溶液含硫酸的总的物质的量,依据V=$\frac{n}{C}$计算体积;
D.烧杯壁和玻璃棒上都沾有硫酸,为保证全部将溶质转移到容量瓶,应进行洗涤,将洗涤液全部转移到容量瓶中;
(4)依据C=$\frac{n}{V}$,分析D操作对n的影响;
(5)容量瓶为精密仪器,物质在溶解或者稀释会放出大量的热.
解答 解:(1)25%的硫酸的物质的量浓度c=$\frac{1000ρω%}{M}$=$\frac{1000×1.18×25%}{98}$=3.0mol/L,故答案为:3.0;
(2)由题意某学生欲配制6.0mol/L的H2SO4 950mL,而实验室无950mL容量瓶,故所以应选择1000mL的容量瓶,故答案为:1000;
(3)欲配制6.0mol/L的H2SO4 1000mL所需硫酸的物质的量=6.0mol/L×1L=6.0mol,①480mL 0.5mol/L的硫酸中含硫酸的物质的量为0.5mol/L×0.48L=0.24mol;②150mL 25%的硫酸(ρ=1.18g/mL)含硫酸的物质的量为3.0mol/L×0.15L=0.45mol,6.0mol-0.24mol-0.45mol=5.31mol,所以需要18mol/L的硫酸的体积V=$\frac{n}{c}$=$\frac{5.31mol}{18mol/L}$=0.2950L,即295.0mL;
故答案为:295.0;
D.烧杯和玻璃棒,正确的实验操作是:用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
故答案为:用适量的水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶中;
(4)依据C=$\frac{n}{V}$,如果省略操作D,则溶质的物质的量n将会偏小,所配溶液的浓度将会偏小,故答案为:偏小;
(5)容量瓶不能受热,故应将将稀释后的硫酸冷却,故答案为:将稀释后的硫酸冷却.
点评 本题考查溶液浓度的计算和一定物质的量浓度溶液的配制,题目难度不大,本题注意配制溶液的操作步骤、仪器以及注意事项,是中学阶段重要的定量实验.

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案| A. | 肯定不存在的离子是Fe3+、Cu2+、CO32-、Br- | |
| B. | 肯定存在的离子是K+、SO42-、SO32- | |
| C. | 无法确定原溶液中是否存在Cl-和CO32- | |
| D. | 若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断也无影响 |
| A. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20 mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):3OH-+2CO2═CO32-+HCO3-+H2O |
| A. | 食物久置后,变质腐败产生异味 | |
| B. | 燃烧液化石油气为炒菜提供热量 | |
| C. | 食醋(CH3COOH)除去水瓶里的水垢[主要成分CaCO3和Mg(OH)2] | |
| D. | 烧菜用过的铁锅出现红棕色斑迹 |
| A. | 氢气通过灼热的氧化铜 H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O | |
| B. | 二氧化碳通过Na2O2粉末 2Na2O2+2CO2═2Na2CO3+O2 | |
| C. | 铝与Fe2O3发生铝热反应 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 | |
| D. | 将锌粒投入Cu(NO3)2溶液 Zn+Cu(NO3)2═Zn(NO3)2+Cu |