题目内容
【题目】我国科技工作者设计了一种电解装置,能合成氨及硝酸,实现高效人工固氮,原理如图所示下列说法正确的是
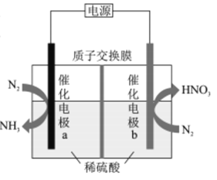
A.催化电极a的电势比催化电极b的电势高
B.负极区的电极反应为N2-10e-+6H2O=2NO3-+12H+
C.若N2得到6mole-,有6molH+向电极b迁移
D.理论上1molN2参与反应转移的电子数为3.75NA
【答案】D
【解析】
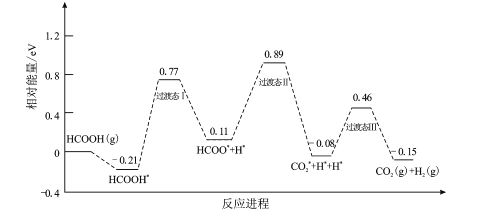
根据图示,该装置为电解池,电极a上氮气转化为氨气,氮元素化合价降低,得电子,发生还原反应,a为阴极,电极反应为N2+6e-+6H+=2NH3;电极b上氮气转化为硝酸,氮元素的化合价升高,失电子,发生氧化反应,电极反应为N2-10e-+H2O=2NO3-+12H+,b为阳极,据此分析解答。
A.根据分析,催化电极a为阴极,与电源负极相连,催化电极b为阳极,与电源正极相连,电源外电路电流从正极流向负极,根据电流总是从高电势流向低电势,则催化电极b的电势比催化电极a的电势高,故A错误;
B.根据分析,b为阳极,与电源正极相连,电极反应为N2-10e-+H2O=2NO3-+12H+,故B错误;
C.电解池中,阳离子向阴极迁移,根据分析,催化电极a为阴极,则H+向电极a迁移,故C错误;
D.根据分析,a为阴极,电极反应为N2+6e-+6H+=2NH3,b为阳极,电极反应为N2-10e-+H2O=2NO3-+12H+,总反应为8N2+3H2O![]() 10NH3+6NO3-+6H+,根据反应可知,8mol氮气参与反应转移30mol电子,则1molN2参与反应转移的电子数为
10NH3+6NO3-+6H+,根据反应可知,8mol氮气参与反应转移30mol电子,则1molN2参与反应转移的电子数为![]() mol×NA=3.75NA,故D正确;
mol×NA=3.75NA,故D正确;
答案选D。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下:
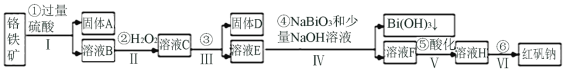
查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为![]() 。
。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)Fe在元素周期表中的位置______________________________,反应之前先将矿石粉碎的目的是__________________。
(2)步骤③加的试剂为_____________,此时溶液pH要调到5的目的______________。
(3)写出反应④的离子反应方程式______________________。
(4)⑤中酸化是使![]() 转化为
转化为![]() ,写出该反应的离子方程式_________________。
,写出该反应的离子方程式_________________。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是__________________(填操作名称)。
【题目】在 3 个体积均为 2.0 L 的恒容密闭容器中,反应H2O(g) + C(s)![]() CO(g) + H2(g) ΔH > 0分别在一定温度下达到化学平衡状态。下列说法正确的是
CO(g) + H2(g) ΔH > 0分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度 (T1>T2) | 起始时物质的量/mol | 平衡时物质的量/mol | |||
n(H2O) | n(C) | n(CO) | n(H2) | n(CO) | ||
I | T1 | 0.5 | 1 | 0 | 0 | 0.25 |
II | T1 | 1 | 1 | 0 | 0 | x |
III | T2 | 0 | 0 | 0.5 | 0.5 | y |
A.当温度为 T1时,该反应的化学平衡常数值为 0.25
B.若 5min 后容器 I 中达到平衡,则 5min 内的平均反应速率:v(H2) = 0.05mol·L-1·min-1
C.达到平衡时,容器 II 中H2O的转化率比容器 I 中的小
D.达到平衡时,容器 III 中的 CO 的转化率小于 50%
【题目】Ⅰ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g)![]() 2NH3(g)
2NH3(g)
(1)已知每破坏1mol有关化学键需要的能量如下表:
H-H | N-H | N-N | N≡N |
435.9KJ | 390.8KJ | 192.8KJ | 945.8KJ |
(1)则反应物的总能量_________(填“>”或 “<”)生成物的总能量
(2)在一定温度下、向2L密闭容器中加入2 molN2、6 mol H2,在适当的催化剂作用下,发生反应 N2 (g)+3H2 (g)![]() 2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
2NH3(g),10min后达到平衡,此时剩余4.5mol H2。
①下列叙述能说明此反应达到平衡状态的是________________________。
a.容器内总压强不变 b.v(H2)正=v(H2)逆 c.N2和H2的浓度相等
d. 2 mol NH3生成的同时有3 moH—H键断裂 e.NH3的浓度不再改变
②0~10 min内的平均反应速率v(H2) 是______mol/(Lmin);10秒末NH3的浓度是______mol/L;N2 的的物质的量________mol
Ⅱ.某温度时,在一个2L的密闭容器中X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示,据此回答:
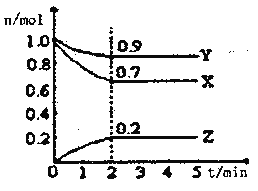
(1)该反应的化学方程式为_______________________
(2)从开始至2min,Z的平均反应速率为____________mol/(L·min);
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量
C.减小压强 D.增加物质Z的物质的量.
E.加入某种催化剂 F.缩小容积 G.使用效率更高的催化剂
(4)该反应正向为放热反应若上述容器为绝热容器(与外界无热交换),则到达平衡所需时间将_________。
a.延长 b.缩短 c.不变 d.无法确定