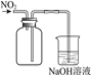题目内容
【题目】在 3 个体积均为 2.0 L 的恒容密闭容器中,反应H2O(g) + C(s)![]() CO(g) + H2(g) ΔH > 0分别在一定温度下达到化学平衡状态。下列说法正确的是
CO(g) + H2(g) ΔH > 0分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度 (T1>T2) | 起始时物质的量/mol | 平衡时物质的量/mol | |||
n(H2O) | n(C) | n(CO) | n(H2) | n(CO) | ||
I | T1 | 0.5 | 1 | 0 | 0 | 0.25 |
II | T1 | 1 | 1 | 0 | 0 | x |
III | T2 | 0 | 0 | 0.5 | 0.5 | y |
A.当温度为 T1时,该反应的化学平衡常数值为 0.25
B.若 5min 后容器 I 中达到平衡,则 5min 内的平均反应速率:v(H2) = 0.05mol·L-1·min-1
C.达到平衡时,容器 II 中H2O的转化率比容器 I 中的小
D.达到平衡时,容器 III 中的 CO 的转化率小于 50%
【答案】C
【解析】
A. 由容器I的数据可知,当温度为 T1时,n(H2O)起始=0.5mol,n(CO)平衡=0.25mol,由于各组分的化学计量数相同,故其变化量均为0.25mol,H2O(g)的转化率为50%,因此,H2O(g)、 CO(g) 、H2(g)的平衡浓度均为0.125mol/L,该反应的化学平衡常数值K=![]() 0.125,A不正确;
0.125,A不正确;
B. 若 5min 后容器 I 中达到平衡,则 5min 内的平均反应速率:v(H2) =![]() 0.025mol·L-1·min-1,B不正确;
0.025mol·L-1·min-1,B不正确;
C. 容器 II中H2O(g)的投料是I的2倍,达到平衡时相当于将容器I压缩到原来的一半,化学平衡将向逆反应方向移动,H2O(g)的转化率减小,因此,容器 II 中H2O的转化率比容器 I 中的小,C正确;
D. 容器 III的投料与容器I相当(容器I中多加的0.5molC可以不考虑,因为其浓度不变),若其在T1达到平衡,CO 的转化率与I的H2O(g)的转化率之和为1,即50%;反应H2O(g) + C(s)![]() CO(g) + H2(g) ΔH > 0,因为T1>T2,降低温度,化学平衡向逆反应方向移动,因此,达到平衡时,容器 III 中的 CO 的转化率大于 50%,D不正确;
CO(g) + H2(g) ΔH > 0,因为T1>T2,降低温度,化学平衡向逆反应方向移动,因此,达到平衡时,容器 III 中的 CO 的转化率大于 50%,D不正确;
综上所述,答案选C。

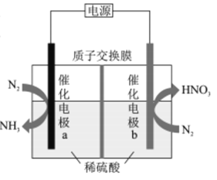
【题目】下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是( )
A | B | C | D | |
实验目的 | 制备氢氧化铁胶体 | 分离乙酸乙酯和饱和Na2CO3溶液 | 除去CO2中的少量HCl | 收集NO2 |
实验装置 |
|
|
|
|
A.AB.BC.CD.D