题目内容
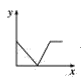
【题目】甲酸被认为是理想的氢能载体,我国科技工作者运用DFT计算研究单分子HCOOH在催化剂表面分解产生H2的反应历程如图所示,其中吸附在催化剂表面的物种用*标注
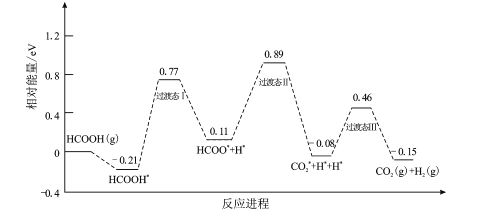
回答下列问题:
(1)该历程中决速步骤的能垒(活化能)E正=__________eV,该步骤的反应方程式为__________
(2)甲酸分解制氢气的热化学方程式为__________
(3)在温度为383K压强为p0时,将一定量的HCOOH气体充入一个盛有催化剂的刚性容器中,达到平衡时,H2的分压为0.55p0,则该反应α(HCOOH)=______________,该温度下的压强平衡常数Kp=__________ (计算结果保留2位有效数字)
(4)HCOOH的分解存在副反应HCOOH(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
已知H2的选择性=![]() 能够增大H2选择性的可能方法是____
能够增大H2选择性的可能方法是____
(5)甲酸作为直接燃料电池的燃料具有能量密度高的优点若电解质溶液显酸性,甲酸直接燃料电池的负极反应式为__________,该电池的理论输出电压为1.48V,能量密度E=________kW·h/kg(能量密度=电池输出电能/燃料质量,1kW·h=3.6×106J)
【答案】0.98 HCOOH*=HCOO*+H* HCOOH(g)=CO2(g)+H2(g) △H=-0.15NAeV/mol 55% 0.67p0 选择合适催化剂 HCOOH-2e-=CO2↑+2H+ 1.72
【解析】
(1)反应所需能垒(活化能)越大,反应速率越慢,而决定该历程反应速率的是反应速率最慢的一步,即决速步骤是能垒最高的一步,该历程中三步的能垒分别为[0.77-(-0.21)]eV=0.98eV、(0.89-0.11)eV=0.78eV、[0.46-(-0.08)]eV=0.54ev,所以该历程中决速步骤的能垒(活化能)E正=0.98eV,该步骤的反应方程式为HCOOH*=HCOO*+H*,故答案为:0.98;HCOOH*=HCOO*+H*;
(2)结合反应历程可知,1molHCOOH(g)分解得到1molCO2(g)和1molH2(g)释放0.15eV能量,所以甲酸分解制氢气的热化学方程式为HCOOH(g)=CO2(g)+H2(g)△H=-0.15NAeV/mol,故答案为:HCOOH(g)=CO2(g)+H2(g)△H=-0.15NAeV/mol;
(3)因为是刚性容器,所以可将分压代入三段式解答,平衡时,H2的分压为0.55p0,所以: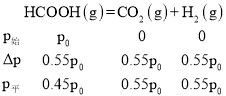 ,所以,α(HCOOH)=
,所以,α(HCOOH)=![]() =55%,Kp=
=55%,Kp=![]() ≈0.67p0,故答案为:55%;0.67p0;
≈0.67p0,故答案为:55%;0.67p0;
(4)可选择合适的催化剂增大氢气的选择性,故答案为:选择合适的催化剂;
(5)甲酸作燃料,失电子,发生的电极反应为:HCOOH-2e-=CO2↑+2H+,1molHCOOH反应转移2mol电子,则1000gHCOOH转移![]() ×2mol电子,所以电池输出电能=1.48V×
×2mol电子,所以电池输出电能=1.48V×![]() ×2mol×96500C/mol,则能量密度E=
×2mol×96500C/mol,则能量密度E=
![]() J/kg=
J/kg= kW·h/kg≈1.72kW·h/kg,故答案为:HCOOH-2e-=CO2↑+2H+;1.72。
kW·h/kg≈1.72kW·h/kg,故答案为:HCOOH-2e-=CO2↑+2H+;1.72。

 快捷英语周周练系列答案
快捷英语周周练系列答案