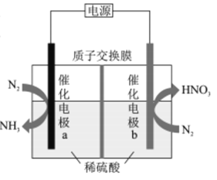
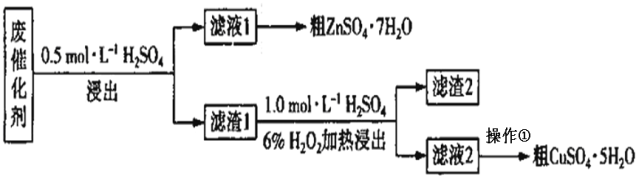
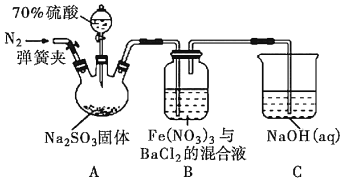
题目内容
【题目】(1) 在含Fe3+的S2O![]() 和I-的混合溶液中,反应S2O
和I-的混合溶液中,反应S2O![]() (aq) + 2I-(aq)=2SO
(aq) + 2I-(aq)=2SO![]() (aq) + I2(aq)的分解机理及反应进行中的能量变化如图所示。
(aq) + I2(aq)的分解机理及反应进行中的能量变化如图所示。
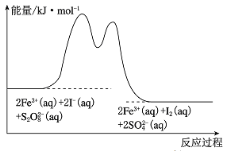
步骤①:2Fe3+(aq) + 2I-(aq) = I2(aq)+ 2Fe2+(aq)
步骤②:2Fe2+(aq) + S2O![]() (aq) = 2Fe3+(aq) + 2SO
(aq) = 2Fe3+(aq) + 2SO![]() (aq)
(aq)
下列有关该反应的说法不正确的是 _______。
A. 该反应为吸热反应
B. Fe3+是该反应的催化剂,能提高反应体系中活化分子百分数
C. 反应速率v(S2O![]() )=2v(SO
)=2v(SO![]() )
)
D. 若不加Fe3+,则正反应的活化能比逆反应的大
(2)一定条件下,工业上可采用CH3OH→CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
① 甲醇脱氢反应的第一步历程,有两种可能方式:
方式A:CH3OH*→CH3O*+H* Ea=+103.1kJ·mol-1 方式B:CH3OH*→CH3*+OH* Eb=+249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要经历的方式应为_____________。(填“A”或“B”)
②下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为 ________________________________ 。
(3)已知298K时,A、B分别为无色气体、深色气体,发生反应:A(g)![]() 2B(g)
2B(g)
①反应达平衡后,扩大容器的体积,再次达到平衡时混合气体的颜色 ____(填“变深”、“变浅”或“不变”)。
②恒容密闭容器中发生上述反应,已知v正=k正·p(A),v逆=k逆·p2(B),Kp=____________ 。(用k正、k逆表示)。若初始压强为100kPa.k正=2.8×104 s-1,当B的体积分数为40%时,v正= _____kPa·s-1[其中p(A)和p(B)分别是A和B的分压, 分压=p总×气体体积分数,k正、k逆为速率常数]
【答案】ACD A CHO*+3H*=CO*+4H* (或CHO*=CO*+H*) 变浅 ![]() 2.1×106
2.1×106
【解析】
(1) A.由图像可知反应物的总能量高于生成物的总能量,该反应为放热反应,故A错误;
B. 反应前后三价铁离子的数目性质为改变,由此可知Fe3+是该反应的催化剂,催化剂可以降低反应所需的活化能从而能提高反应体系中活化分子百分数,加快反应速率,故B正确;
C.反应速率之比等于化学计量数之比,由反应可得速率2v(S2O![]() )=v(SO
)=v(SO![]() ),故C错误;
),故C错误;
D.活化能可视为是物质到过渡态的能量,由图像可知,正反应的活化能小于逆反应的活化能,加催化剂并不能改变正逆反应活化能的相对大小,故D错误;
故答案为:ACD;
(2) 方式A所需活化能更低,所以甲醇裂解过程主要历经的方式应为A,由图象可知,相对能量从112降至65时,放出的热量最多,放热最多的步骤的化学方程式为CHO*+3H*═CO*+4H*(或CHO*═CO*+H*),故答案为:A;CHO*+3H*═CO*+4H*(或CHO*═CO*+H*);
(3) ①反应达平衡后,扩大容器的体积,各物质的浓度减小,虽然平衡正向移动,但无法抵消B浓度的下降,因此颜色变浅,故答案为:变浅;
②恒容密闭容器中发生上述反应,当反应达到平衡时v正= v逆,联立可得k正·p(A) =k逆·p2(B),Kp=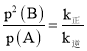 ;A(g)
;A(g)![]() 2B(g) 设起始时A的物种的量为amol,则amol气体对应的压强为100kPa,设A的变化量为xmol,列出三段式:
2B(g) 设起始时A的物种的量为amol,则amol气体对应的压强为100kPa,设A的变化量为xmol,列出三段式:

B的体积分数为40%则:![]() ,x=0.25a,此时气体的总物质的量为:1.25a,由压强之比等于气体的物质的量之比可得此时体系内压强为:125 kPa,p(A)=
,x=0.25a,此时气体的总物质的量为:1.25a,由压强之比等于气体的物质的量之比可得此时体系内压强为:125 kPa,p(A)=![]() ,v正=k正·p(A)=
,v正=k正·p(A)=![]() ,故答案为:
,故答案为:![]() ;2.1×106
;2.1×106

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】下列实验操作、现象和所得结论均正确的是( )
选项 | 实验内容 | 实验结论 |
A | 向盛有5mL0.005mol/L FeCl3溶液中加入5mL0.01mol/LKSCN溶液,再继续加入少量KCl固体,观察现象 | 证明溶液存在平衡: FeCl3+3KSCNFe(SCN)3+3KCl |
B | 取两只试管,分别加入等体积等浓度的双氧水,然后试管①中加入0.01mol/LFeCl3溶液2mL,试管②中加入0.01mol/LCuCl2溶液2mL,试管①产生气泡快 | 加入FeCl3时,双氧水分解反应的活化能较大 |
C | 检验FeCl3溶液中是否含有Fe2+时,将溶液滴入酸性KMnO4溶液,溶液紫红色褪去 | 不能证明溶液中含有Fe2+ |
D | 取两只试管分别加入4mL0.01mol/LKMnO4酸性溶液,然后向一只试管中加入0.01mol/L H2C2O4溶液2mL,向另一只试管中加入0.01mol/L H2C2O4溶液4mL,第一只试管中褪色时间长 | H2C2O4浓度越大,反应速率越快 |
A.AB.BC.CD.D